Химия и биология белков - Ф. Гауровитц 1953
Взаимодействие белков с водой
Гидратация сухих белков
Уже давно хорошо известно, что длина кератиновых волокон зависит от количества связанной ими воды; это свойство позволило использовать волос в качестве нити в гигрометре. Подобным же образом ведут себя и другие белки, так как все они, находясь в атмосфере водяного пара, связывают воду. Кривые на фиг. 23 показывают поглощение воды белками, высушенными в вакууме над пятихлористой окисью фосфора при комнатной температуре. На фигуре видно, что поглощение воды протекает с наибольшей скоростью до тех пор, пока не наступает определенная степень насыщения.
Количество связанной воды зависит от температуры и от давления водяного пара (фиг. 24) [3, 4]. На фигуре представлена S-образная кривая, характеризующая эту зависимость. Подобные же кривые получены для всех исследованных белков [3].
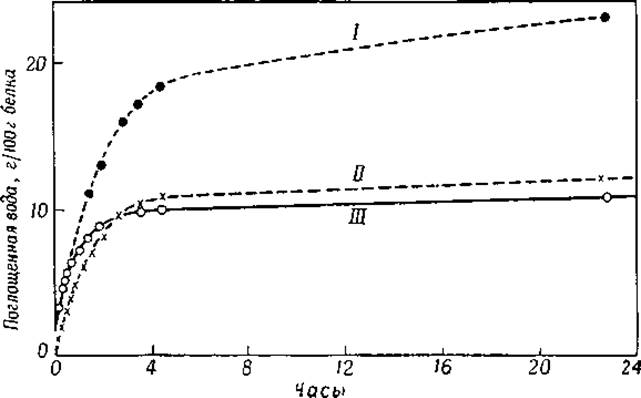
Фиг. 23. Поглощение паров воды сухими белками [18] при 20°; относительная влажность 50%.
I — коллаген; II — сывороточный альбумин; III — зеин.
Они показывают, что некоторое количество воды (а) связывается белками очень прочно и освобождается только при очень низких давлениях; другая часть воды (b), близкая по величине к а, присоединяется в том случае, если упругость водяных паров возрастает. При высоких давлениях водяного пара количество связанной белком воды резко увеличивается. При связывании воды яичным альбумином увеличение происходит до тех пор, пока около 40 г воды не свяжется с 100 г белка. Количество воды а варьирует от 4 до 10 г, а максимальное количество воды, которое может быть связано белком, колеблется от 20 до 60 г на 100 г белка [3, 5, 6].
Своеобразная форма кривой гидратации не может быть объяснена простой адсорбцией воды или образованием стехиометрических гидратов. Количество воды а, соответствующее первому подъему кривой, составляет около 1/5 количества, необходимого для того, чтобы покрыть всю белковую молекулу мономолeкулярным слоем. Поэтому предполагают, что эта часть воды связана с определенными гидрофильными группами и образует мономолекулярный слой между цепями пептидов [2, 3]. Количество воды b, приблизительно равное а, идет, вероятно, на образование второго слоя. Второй слой образуется над теми же гидрофильными группами, что и первый, так что каждая из соседних цепей пептида имеет свой гидратный слой.
Возникает, однако, вопрос, не могут ли второй и последующие слои молекул воды связаться с первым слоем ориентированных
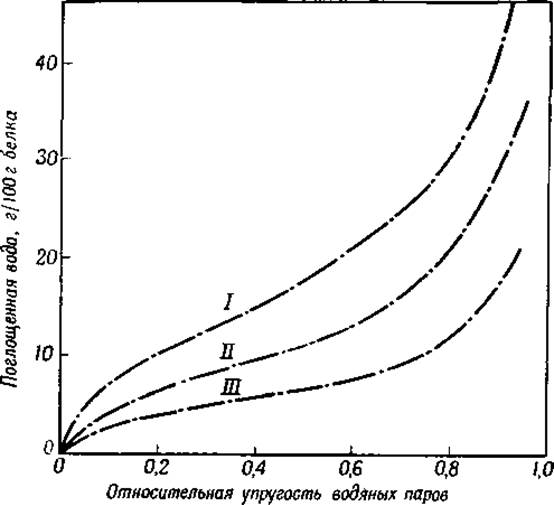
Фиг. 24. Поглощение паров воды сухими белками [3] при 25°.
І — коллаген; ІІ — сывороточный альбумин; ІІІ — зеин.
молекул воды за счет индукции диполей? Выяснение этого вопроса важно для понимания природы сил, действующих в биологических системах. В настоящее время наличие многочисленных слоев ориентированных молекул воды принимается одними исследователями [7] и отрицается другими [8]. Брунауэр, Эммет и Теллер [9] рассчитали, с какой силой водный слой т удерживается слоем (m—1). Они нашли, что эта сила может удержать в ориентированном положении только один слой молекул воды. Подобные же результаты получил Гаркинс [10]. Он рассчитал, что при образовании первого гидратного слоя на ТiO2 освобождается 6 550 кал на 1 моль воды, при образовании второго гидратного слоя — 1 380 кал, третьего — 220 кал и четвертого — 70 кал. Поскольку последние величины ниже значений энергии тепловых движений молекулы воды, третий и четвертый ориентированные слои диполей воды вряд ли вообще могут образовываться.
Подобные же расчеты показали, что при поглощении воды сухим белком при низком давлении водяного пара (левая часть кривой на фиг. 24) выделяется от 3 000 до 6 000 кал на 1 моль воды [11]. Энергия связи второго слоя воды (середина кривой на фиг. 24) значительно ниже. Дальнейшее присоединение воды (правая часть кривой на фиг. 24), вероятно, обусловлено конденсацией неориентированных молекул воды на гидратированной поверхности; это явление можно сравнить с образованием тумана в газах. В основе первого процесса лежит адсорбция ориентированных слоев полярных молекул воды, ведущая к увеличению упорядоченности в системе, т. е. к уменьшению энтропии; в основе второго процесса (правая часть кривой на фиг. 24) лежит тенденция пептидных цепей к растворению в воде, ведущая к уменьшению упорядоченности в системе, т. е. к увеличению энтропии [12].
Доказательством того, что первые порции воды присоединяются к белку с большой силой, служит заметное сокращение объема системы, сопровождающее этот процесс. При присоединении к сухому яичному альбумину 6,15% воды его плотность (D) возрастает с 1,2655 до 1,2855. Удельный объем белка соответственно уменьшается с 1/1,2655 = 0,792 мл/г до 1/1,2855 = 0,777 мл/г. Если этот процесс идет дальше и количество присоединенной воды увеличивается, то плотность белка уменьшается. Плотность яичного альбумина, содержащего на 100 г белка 56,26 г воды, равна 1,1280 (Vуд. = 0,887) [13]. Важные данные о гидратации белковых кристаллов были получены при помощи рентгеноструктурного анализа этих кристаллов. Так, например, было показано, что кристаллы сохраняют свою первоначальную форму как в атмосфере с различной упругостью водяного пара, так и в солевых растворах различной концентрации; при указанных условиях наблюдается только постепенное набухание или сжатие первичных ячеек кристаллов. Это дало основание заключить, что вода присоединяется главным образом к поверхности белковых молекул и не проникает внутрь [14]. Количество воды в белковых кристаллах варьирует в широких пределах. Так, в кристаллах инсулина содержится 32% воды, в кристаллах же тропомиозина содержание воды превышает 90%.
В настоящее время нет единого мнения по вопросу о том, к каким химическим группировкам в белках присоединяется вода. На основании данных рентгеноструктурного анализа можно предположить, что гидратная вода покрывает поверхность молекулы; некоторые авторы, однако, считают, что гидратная вода присоединяется к ионным группировкам белка или к другим полярным группам, таким, как пептидные связи, Общее число молекул присоединенной воды приблизительно соответствует числу положительно и отрицательно заряженных ионных групп [16]. Степень гидратации уменьшается при бензоилировании белков, но почти не меняется при восстановлении дисульфидных связей или при метилировании [17]; метилированные зеин, фиброин и гемоглобин присоединяют приблизительно такое же количество воды, как и неметилированные белки [18].
Не только ионные группировки, но также и пептидные связи —СО ∙ NH — могут, повидимому, служить местом присоединения гидратной воды, так как было показано, что пептиды, синтезированные из аминокислот, не обладающих способностью присоединять воду, приобретают эту способность [19]. Более того, нейлон, который можно рассматривать как искусственный полипептид с формулой
...NH ∙ R ∙ NH — СО ∙ R ∙ СО—NH ∙ R ∙ NH—СО ∙ R ∙ СО—...
также присоединяет воду в соответствии с типичной S-образной кривой (см. фиг. 24) [3]. Поскольку нейлон не имеет ионных боковых цепей, большая часть воды, несомненно, присоединяется к пептидным связям; причем возможно, что молекулы воды внедряются между двумя пептидными связями смежных пептидных цепей. Надо, однако, указать, что между количеством воды, связанным различными белками, и числом пептидных связей пропорциональности нет. Так, например, фиброин шелка, особенно богатый пептидными связями (см. табл. 1, гл. III), присоединяет меньше воды, чем содержащий значительно меньше пептидных связей кератин [3].