Химия и биология белков - Ф. Гауровитц 1953
Внутренняя структура глобулярных белков
Замещение концевых аминогрупп
Свободные аминогруппы белков легко алкилируются или ацетилируются. При их обработке диметилсульфатом (CH3)2SO4 [9] или диазометаном CH2N2[10] образуются О- или N-метилпроизводные аминокислот. Ацетильные производные аминокислот могут быть получены при нагревании аминокислот с уксусным ангидридом (СН3СO)2O [10] или, что предпочтительнее, при пропускании через раствор белков газообразного кетена СН2 = СО [11]. Фосфопротеиды получаются при реакции белков с хлорокисью фосфора РОСl3 [12, 13, 14].
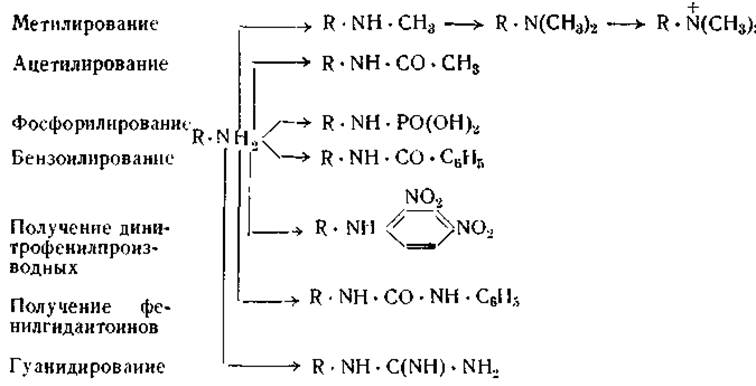
Бензоильные производные белков можно получить при обработке растворов белков в разведенном углекислом натрии бензоил хлоридом С6Н5СОСl [15]. Ацильные группировки, вошедшие в белки, отщепляются в процесе кислотного или щелочного гидролиза, вследствие чего соответствующие производные белков не могут быть использованы для определения числа концевых аминогрупп. При воздействии О-метилизомочевины аминогруппа лизина образует гуанидиновую группировку, в результате чего получаются гуанидизированные белки:
Важные результаты получили Сенджером и Портер [17], которые алкилировали растворы белков в двууглекислом натрии 1-фтор-2,4-динитробензолом. N-динитрофенилпроизводные белков затем гидролизовались, и образовавшиеся динитрофениламинокислоты, имеющие желтую окраску, разделялись хроматографическим методом. Этим путем было установлено, что концевые d-аминогруппы гемоглобина лошади принадлежат 6 молекулам валина. Миоглобин имеет только одну концевую d-аминогруппу, принадлежащую глицину. При гидролизе инсулина были получены две молекулы динитрофенилглицина и две — динитрофенилаланина (при расчете на молекулярный вес 12 000) [18]. Аналогичные результаты были получены и по методу противоточного распределения динитрофенилпептидов [19]. Все гидролизаты содержали также динитрофенилпроизводные лизина. Важное значение указанных исследований заключается в том, что они свидетельствуют о наличии более чем одной концевой f-аминогруппы в каждой молекуле белка. В соответствии с этим молекулы гемоглобина и инсулина не могут состоять из прямых неразветвленных пептидных цепей. Они содержат либо разветвленные пептидные цепи, либо несколько пептидных цепей, соединенных друг с другом цистиновыми мостиками или какими-нибудь другими связями. В отличие от гемоглобина и инсулина яичный альбумин совершенно не содержит концевых «-аминогрупп [20]; у эдестина же их было найдено 7, у у-глобулина 1, у ß-лактоглобулина 3 [21]. Концевые а-аминогруппы белков легко вступают в соединение с фенилизоцианатом C6H5NCO, образуя фенилгидантоины. Фенилаланин реагирует с фенилизоцианатом, согласно следующему уравнению:
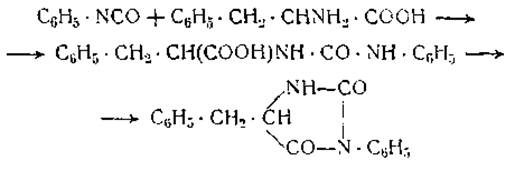
Фенилгидантоиновое производное фенилаланина было получено из инсулина и в небольших количествах также из казеина, глобина и яичного альбумина [23].
При реакции с С3O2 свободные аминогруппы белков образуют малоновые производные [24]:
![]()
Представляет также известный интерес реакция замещения, происходящая при действии на свободные аминогруппы белков иприта. В результате этой реакции образуются тиазановые кольца [25—27]:
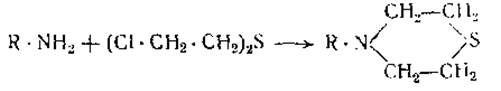
Производные аминокислот, в которых замещен водород аминогруппы, можно отделить от производных, в которых замещен водород оксигруппы, воспользовавшись для этой цели более легкой расщепляемостью последних. Значительные затруднения, однако, возникают тогда, когда замещение происходит не в концевой аминогруппе, а в иминогруппе, образующей пептидную связь. Как показали результаты ряда исследований [28, 29], метилирование при помощи диметилсульфата или ацетилирование уксусным ангидридом ведет к замещению у атома азота, входящего в пептидную связь.
В связи с указанным, для определения концевых аминогрупп пытались воспользоваться методом выделения продуктов окисления аминокислот. Этот метод основан на том, что аминокислоты легко окисляются, если их аминогруппа свободна, и не окисляются, если их аминогруппа образует пептидную связь [30]. Так, например, окисление пептидов при помощи NaOBr ведет к образованию из концевых аминокислот углекислоты и нитрила [30]:
![]()
Подобным же образом хромовая кислота окисляет только те молекулы лейцина и валина, входящие в состав казеина, которые имеют свободную d-аминогруппу [31].
Поскольку при воздействии азотистой кислоты свободные аминогруппы образуют гидроксилы, эта реакция также была использована для определения свободных d-аминогрупп в белках и белковых гидролизатах [32]. Этим методом было обнаружено, что ни глутаминовая кислота, ни глутамин, входящие в состав белков, не обладают свободными аминогруппами [33].