Химия и биология белков - Ф. Гауровитц 1953
Внутренняя структура глобулярных белков
Циклические структуры в белках
При нагревании метиловых или этиловых эфиров аминокислот образуются циклопептиды. Простейшим кольцом, полученным этим путем, является кольцо дикетопиперазина:
![]()
Дикетопиперазины были получены также при частичном гидролизе белков. Так, например, при обработке фиброина 70-процентной серной кислотой при комнатной температуре были получены глицилаланинангидрид и глицилтирозинангидрид [59]. Хотя из аминокислот при этих условиях ангидриды не образуются, все же при малом содержании воды вторичное образование этих циклических группировок полностью не исключено [60]. Если же допустить, что в упомянутых опытах дикетопиперазиновые группировки существовали в составе нативных белков, то возникает вопрос относительно их связей внутри макромолекулы белка. Протеолитические ферменты неспособны расщеплять дикетопиперазиновые группировки [61, 62]. Это делает сомнительным предположение о наличии дикетопиперазиновых группировок в нативных белках и заставляет полагать, что они вторично образуются при гидролизе белков1. То же относится и к ангидридам, полученным при более жестких условиях гидролиза, например при нагревании белков в безводном глицерине при 130—150° [63]. Было установлено, что свободные аминогруппы лизина в молекуле белка изменяются при такой обработке, причем, вероятно, происходит соединение этих групп с карбоксильными группами дикарбоновых аминокислот [64, 65]. Указанные методы были использованы для приготовления циклопептидов, содержащих большое число аминокислотных остатков. Так, при нагревании метилового эфира аланилглицилглицина были получены циклопептиды, содержащие около 20 аминокислотных остатков [66]. Некоторые из этих циклопептидов, не содержащих концевых свободных аминных и карбоксильных групп, расщепляются эндопептидазами, т. е. протеолитическими ферментами, действующими на внутренние пептидные связи [67]. Естественные циклопептиды этого рода были обнаружены в некоторых бактериальных токсинах (см. гл. XV).
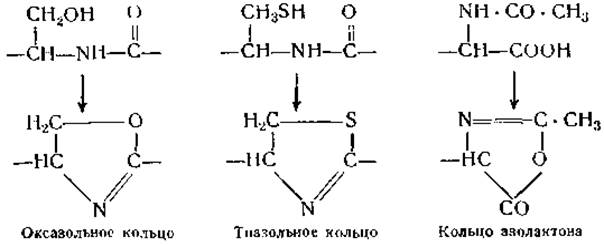
Циклические ангидриды могут образовываться не только при конденсации аминных и карбоксильных групп, но также в результате соединения аминных и карбоксильных групп с гидроксилами или тиогруппами; при этом образуются океазольныe и тиазольные группировки, а также азолактоны.
1 Выставляя положение о том, что наличие дикетопиперазиновых группировок в нативных белках экспериментально не доказано и что эти группировки, вероятно, образуются вторично при гидролизе белков, автор совершенно игнорирует получившие широкую известность многочисленные исследования академика Н. Д. Зелинского и его сотрудников (В. С. Садикова, Н. И. Гаврилова и др.), в которых приводятся как экспериментальные доказательства наличия этих группировок в нативных белках, так и данные об их расщепляемости протеолитическими ферментами. Согласно дикетопиперазиновой теории, сформулированной Н. Д. Зелинским и В. С. Садиковым еще в 1923 г., циклические группировки являются одним из основных структурных элементов белковой молекулы, в значительной степени определяющим важнейшие ее свойства.
В дальнейших исследованиях Н. И. Гаврилова и А. В. Копериной было показано, что количество азота, входящего в состав циклических группировок, составляет в отдельных белках от 8,4 до 27,6% по отношению к общему содержанию азота в этих белках. Так, например, в сывороточном альбумине это количество равно 21,6%, в желатине — 27,6%, а в стурине — 8,4% (Н. И. Гаврилов и А. В. Коперина, Журнал общей химии, 17, 335, 1947; Н. И. Гаврилов, Тезисы докладов на второй сессии медико-биологического отделения АМН СССР, 4, 1949). Эти данные были получены при электровосстановлении указанных белков в условиях, при которых восстановление пептидных группировок исключалось. На основании этих данных было высчитано также отношение между числом аминокислот, образующих циклические группировки, и числом аминокислот, входящих в состав пептидных цепей. Оказалось, что на каждые две молекулы аминокислот, образующих циклическую дикетопиперазиновую группировку приходится в желатине 4 аминокислоты пептидных цепей, в сывороточном альбумине 5, а в стурине 6. Н. Д. Зелинским и Н. И. Гавриловым было выдвинуто положение, что наиболее вероятной формой связи между циклическими дикетопиперазиновыми группировками в белковой молекуле и пептидными цепями является амидиновая связь, осуществляемая свободной аминной группой пептида и карбонильной группой дикетопиперазина.
Синтезированная по этому типу глициновая модель микромолекулы белка, содержавшая одно пиперазиновое ядро и две трипептидных белковых цепи, по данным авторов (Н. Д. Зелинский, Н. И. Гаврилов, Л. Н. Акимова, Журнал общей химии, 18, 960, 1948), обладала амфотерным характером, давала типичную для белков биуретовую реакцию и гидролизовалась протеолитическими ферментами желудочного и кишечного сока.
Все приведенные данные, таким образом, показывают, что автор дайной книги совершенно неправ, когда он утверждает, что нет никаких убедительных доказательств наличия циклических группировок типа дикетопиперазинов в нативных белках, и когда он в своей концепции относительно строения белковой молекулы исходит только из представления о пептидных цепях, связанных друг с другом различными связями. Весь вопрос, конечно, нуждается еще в дальнейших исследованиях. Это в особенности относится к выяснению характера связей между циклическими группировками и пептидными цепями. Ясно, однако, что в настоящее время нет никаких оснований отбрасывать дикетопиперазиновую теорию и объявлять ее беспочвенной. — Прим. ред.
Возможность существования в белках подобных кольцевых группировок неоднократно служила предметом обсуждения, однако до сих пор не представлено никаких экспериментальных доказательств их наличия [68, 69]. Вопрос о возможности существования в белках связи —S ∙ СО— был разрешен отрицательно после того, как было найдено, что при реакции сульфгидрильных групп нативных белков с иодом не происходит увеличения количества кислых групп [70].
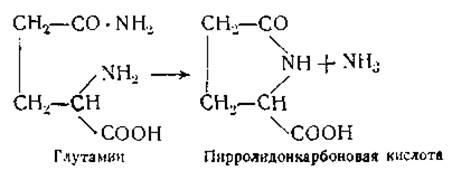
Если подвергнуть белки действию металлического натрия в амиловом спирте, то образуются пирроловые основания и другие гетероциклические соединения [71]. Высказывалось предположение, что эти циклические соединения входят в состав молекулы нативного белка. Подобные соединения, однако, получаются и при нагревании аминокислот. Так, например, глутаминовая кислота и глутамин при нагревании легко и почти количественно превращаются в пирроловые производные:
Признание наличия гетероциклических колец в молекуле белков было бы также несовместимо с данными об оптических свойствах белков (см. гл. VII).
На основе изучения рентгенограмм кристаллических белков было высказано предположение о том, что в белках имеются триокситриазиновые кольца, образующиеся при конденсации трех энолизованных пептидов [72]:
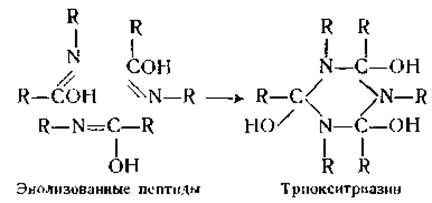
Это предположение, однако, было подвергнуто критике как со стороны специалистов по рентгенограммам белков, так и со стороны физико-химиков [73]. Оно было отвергнуто на том основании, что в белках нет достаточного числа гидроксильных групп, необходимого для образования подобных соединений [74].
Было также установлено, что размеры кристаллической решетки полимеров триокситриазиновых колец таковы, что она может содержать только глицин и аланин, для боковых же цепей других аминокислот места нет [75]. Наконец, было установлено, что предположение о наличии в белках триокситриазиновых колец неприемлемо с энергетической точки зрения [76]. При исследовании большого числа соединений, содержащих группы —СО ∙ NH—, было показано также, что превращение этих групп в группы —C(OH)=N— связано с образованием ароматических колец [77]. Освобождающаяся при образовании этих колец энергия используется для образования энолизованной лактимной связи [77].
Наличие в белках других кольцевых структур также мало вероятно. Если бы белки содержали циклические группировки, расщепляемые гидролитическими агентами, то гидролиз в присутствии тяжелой воды должен был бы вести к образованию соединений, содержащих прочно связанный дейтерий. Этого, однако, не наблюдалось при гидролизе казеина трипсином в присутствии тяжелой воды [78]1. Таким образом, нет оснований считать, что в белках содержатся какие-либо другие циклические группировки, кроме входящих в состав ароматических и гетеро циклических аминокислот.