Химия и биология белков - Ф. Гауровитц 1953
Внутренняя структура глобулярных белков
Замещения в других группах
Одним из реактивов, часто применяющихся в химии белка, является формальдегид [41]. Ранее уже указывалось (см. гл. III), что формальдегид реагирует с аминогруппами таким образом, что в его присутствии аминокислоты могут титроваться едкой щелочью. До недавнего времени принималось, что формальдегид дает соединение с свободными аминогруппами, образуя шиффовы основания, согласно уравнению
![]()
В последнее время, однако, было установлено, что в действительности реакция между формальдегидом и аминокислотами является гораздо более сложной. Формальдегид соединяется с двумя аминогруппами двух соседних пептидных цепей, образуя между ними метиленовые мостики следующей структуры: N—СН2—N [42, 43].
Эта реакция протекает также тогда, когда одна аминогруппа заменяется амидной группой — СО ∙ NH2, индольной группировкой триптофана, бензольным кольцом тирозина, имидазольным кольцом гистидина или же группой NH, образующей пептидную связь [45]. Различные связи, которые получаются при этом, образуют мостики между пептидными цепями, причем растворимые белки превращаются в нерастворимые соединения, обладающие лишь способностью до известного предела набухан, в воде [46].
Гидроксильные группы оксиаминокислот могут образовывать эфирные связи при реакции с концентрированной серной кислотой, хлорсульфоновой кислотой или пятиокисью фосфора [34, 47]. Кислород гидроксила, в противоположность кислороду карбоксильной группы, не обменивается на О18 при растворении белков в Н2O18 [48].
Замещение в ароматическом кольце тирозина может быть легко достигнуто при реакции белков с галогенами, азотной кислотой или диазосоединениями. Иодированные белки получаются при прибавлении к растворам белков раствора иода в йодистом калии при слабо щелочной реакции [49]. Иод замещает водород в положениях 3 и 5 фенольного кольца тирозина [50]. Продолжительное воздействие иода на белки ведет к образованию тироксина:
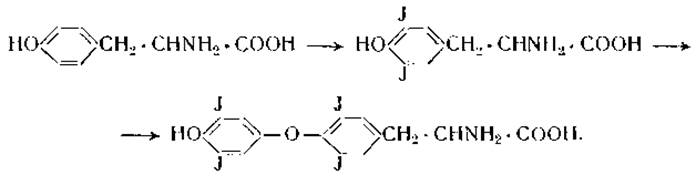
Азотная кислота реагирует не только с ароматическими аминокислотами, но и с гуанидиновой группировкой аргинина [51]:
![]()
При этом под воздействием азотистой кислоты (образующейся из азотной) может произойти дезаминирование. Чтобы избежать этого, азотистую кислоту разрушают добавлением мочевины. Существенное осложнение реакции с азотной кислотой связано с тем, что азотная кислота оказывает на белки гидролизующее и окисляющее действие.
Реакции белков е диазосоединениями получили широкое распространение в связи с тем, что они протекают при низкой температуре и при слабо щелочной реакции, что уменьшает опасность денатурации белков. Ландштейнер [52], используя эту реакцию, приготовил много азобелков, применяемых как специфические антигены. При изменении количества азосоединений, участвующих в реакции, могут быть изготовлены белки, содержащие различное число азогрупп [53, 54]. Азосоединения реагируют главным образом с ароматическим кольцом тирозина и с имидазольным кольцом гистидина [55]:
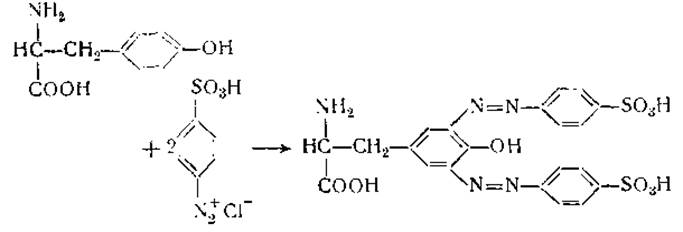
При избытке диазосоединений они могут вступать в реакцию и с другими аминокислотами, кроме тирозина и гистидина [56—58]. При этих условиях реакция происходит с аминогруппами и другими функциональными группами белков.
При оценке результатов, полученных при помощи всех описанных выше реакций, можно прийти к заключению, что, по крайней мере, часть гидроксилов оксиаминокислот, имидазольных колец гистидина и гуанидиновых группировок аргинина находится в белках в виде свободных реактивных групп. Количественные определения показали, однако, что в нативных белках не все свободные группы являются реактивными. Значительное количество этих групп скрыто между складками пептидных цепей и вследствие этого недоступно для воздействия различных реактивов. При денатурации белков и выпрямлении пептидных цепей ранее скрытые реакционноспособные группировки становятся доступными для реакций замещения (см. стр. 149).