Химия и биология белков - Ф. Гауровитц 1953
Внутренняя структура глобулярных белков
Диэлектрическая постоянная растворов белков
Определение диэлектрической постоянной может дать представление о полярных свойствах исследуемых соединений. Это определение производится путем измерения электростатических сил между двумя заряженными пластинками конденсатора сначала в вакууме, а затем в растворе исследуемого вещества. Если электростатическую силу в вакууме обозначить через v0, а в растворе исследуемого вещества через vр, то оказывается, что vp всегда меньше, чем v0. Отношение v0/vp называют диэлектрической постоянной.
Величина диэлектрической постоянной, повидимому, определяется тем, какой структурой — полярной или неполярной — обладают молекулы, так как высокие диэлектрические постоянные были найдены для растворов полярных соединений, а низкие — для растворов неполярных соединений. Цвиттерионы являются высокополярными соединениями, поэтому можно было ожидать, что они будут обладать высокими диэлектрическими постоянными. К сожалению, прямых методов определения диэлектрических постоянных аминокислот и белков нет, так как ни аминокислоты, ни белки не могут быть переведены в жидкое состояние без разрушения. Точка плавления аминокислот и белков настолько высока, что их молекулы разрушаются прежде, чем наступит расплавление. Ценные результаты были, однако, получены при определении диэлектрических постоянных водных растворов белков. Вода сама имеет высокую диэлектрическую постоянную, доходящую до 80 при температуре 20°. Диэлектрическая же постоянная спирта равна 24, этилового эфира — 4,3, а парафина — меньше 2. Высокая диэлектрическая постоянная воды обусловлена ее полярностью (см. гл. VI). При растворении в воде молекул органических соединений диэлектрическая постоянная воды обычно понижается. При растворении же в воде аминокислот или белков диэлектрическая постоянная воды возрастает. Это атипичное влияние аминокислот и белков обусловлено тем, что они представляют собой высокополярные соединения. Повышение диэлектрической постоянной, различное для отдельных аминокислот, пептидов и белков, пропорционально концентрации соединения в растворе. Если диэлектрическую постоянную воды обозначить через Dв, диэлектрическую постоянную раствора исследуемого вещества через D, а молярную концентрацию растворенного вещества через С, то молярный прирост диэлектрической постоянной будет равен lм = (Dр — DB)/C. Повышение, вызываемое растворением аминокислот в воде, колеблется между 22 и 28, пептиды же обусловливают более значительное повышение. Для пептидов, содержащих 2, 3, 4, 5 и 6 аминокислот, были получены соответственно следующие величины: 70, 113, 159, 215, 239 [122]. Нужно, однако, помнить, что молярные растворы более крупных пептидов содержат больше вещества на единицу объема. Если разделить приведенные выше величины на число молекул глицина, содержащегося в указанных пептидах, то для одной молекулы глицина получатся следующие величины: 35, 38, 40, 43 и 39. Из этих данных видно, что прирост диэлектрической постоянной воды будет одинаковым при растворении в воде одинаковых весовых количеств триглицина и гексаглицина.
Повышение диэлектрической постоянной воды, вызываемое растворением в воде белков, колеблется в весьма широких пределах. Поскольку концентрацию белка в растворе не принято выражать в молях, молярное повышение постоянной iм нужно заменить на t1 — повышение на 1 г белка. Приведенное выше равенство в этом случае примет следующий вид i1, = (Dp — Dв)/c, где с — концентрация в граммах на 1 л. Величины ім и іГ, найденные для различных аминокислот и белков, приводятся в табл. 10.
При расчете прироста диэлектрической постоянной на 1 г аминокислоты были найдены величины, колеблющиеся между 0,18 и 0,36, т. е. величины того же порядка, что и для растворов белка. Пока еще довольно трудно дать объяснение тому факту, что диэлектрическая постоянная воды повышается на одну и ту же величину при растворении в ней 1 г аминокислоты и 1 г белка. Возможно, что это обусловлено двумя компенсирующими друг друга влияниями. В том случае, когда в воде растворяются аминокислоты, мы имеем дело с большим числом небольших диполей, при растворении же белков — с небольшим количеством больших диполей. Чем выше дипольный момент, тем больше должен быть прирост диэлектрической постоянной.
Таблица 10 Повышение диэлектрической постоянной воды при растворении в воде белков
|
Прирост диэлектрической постоянной |
Вещество |
Прирост диэлектрической Постоянной іГ |
||
|
Вещество |
іМ |
іГ |
||
|
Глицин |
22.6 |
0,30 |
Яичный альбумин |
0,1 |
|
Аланин |
23,2 |
0,26 |
Глиадин |
0,1 |
|
Валин |
25 |
0,21 |
Сывороточный альбумин |
0,17 |
|
Лейцин |
25 |
0,19 |
Инсулин |
0,3 |
|
Диглицин |
70,6 |
0,54 |
Карбоксигемоглобин |
0,33 |
|
Триглицин |
1131 |
0,60 |
Зеин |
0,4 |
|
Тетраглицин |
159 |
0,65 |
Эдестин |
0,7 |
|
Пентаглицин |
215 |
0,71 |
Сывороточный псевдоглобулин.................. |
1,1 |
|
Гексаглицин |
239 |
0,65 |
Лактоглобулин |
1,5 |
Величину дипольного момента d-аминокислот можно определить путем измерения расстояния между положительными и отрицательными группами. Это расстояние равно приблизительно 3 Å (3∙10-8 см), а заряд электрона равен 4,8∙10-10 электростатических единиц. Из этих данных можно рассчитать, что дипольный момент а-аминокислот равен приблизительно 15∙10-18 электростатическим единицам, т. е. 15 дебаям. Поскольку у всех a-аминокислот расстояние между положительно и отрицательно заряженными группами одинаково, их дипольный момент также будет одинаковым, а так как повышение диэлектрической постоянной пропорционально дипольному моменту, то неудивительно, что все аминокислоты имеют диэлектрическую постоянную одного и того же порядка.
В молекулах белков лишь небольшое число аминокислот содержит свободные положительно или отрицательно заряженные группы. При первом приближении можно принять, что из каждых 10 аминокислот, входящих в состав белка, лишь одна имеет положительно заряженную группу, и одна — отрицательно заряженную группу. Отсюда следует, что число зарядов в 1 г белка составляет приблизительно 0,1 числа зарядов в 1 г соответствующей смеси аминокислот. Так как повышение диэлектрической постоянной воды, происходящее при растворении белков, заметно не отличается от повышения, вызываемого растворением аминокислот, то необходимо принять, что расстояния между заряженными группами в белках значительно больше, чем в аминокислотах. Только при этом условии белки будут обладать таким же высоким дипольным моментом как аминокислоты. Нельзя, однако, считать, что все положительно заряженные группы расположены на одной стороне белковой молекулы, а все отрицательные — на противоположной. Если бы это было так, то повышение диэлектрической постоянной было бы гораздо большим, чем то, которое наблюдается в действительности. Можно считать, что величины, найденные для белков, свидетельствуют о том, что электрические заряды в их молекулах расположены с высокой степенью симметрии [124].
Диэлектрическая постоянная белковых растворов варьирует в зависимости от pH раствора и достигает максимума при изоэлектрической точке, т. е. тогда, когда электрические заряды в белке также достигают своего максимума (см. гл. V). Диэлектрическая постоянная находится в зависимости также от частоты поля. Применяя для определения диэлектрической постоянной поля с различной частотой, можно получить представление об отношении осей в белковой молекуле.
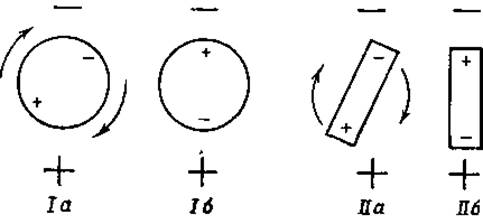
Фиг. 28. Ориентация диполей в электрическом поле.
Основы этого метода вкратце излагаются ниже.
Если полярную молекулу (диполь) поместить в электрическое поле, то она ориентируется таким образом, чтобы ее положительный полюс был направлен к внешнему отрицательному полюсу (фиг. 28), а ее отрицательный полюс — к внешнему положительному полюсу. При этом, если полярная молекула имеет шарообразую форму и расстояния полюсов от центра шара одинаковы, то произойдет поворот молекулы вокруг ее оси, как это показано на фиг. 28 (положения Iа и Iб). Если же полярная молекула не имеет формы шара, то вся молекула, под влиянием электростатических сил, воздействующих на оба ее полюса, переместится и примет ту ориентацию, которая показана на фиг. 28 (положения IIа и IIб). Время, необходимое для осуществления подобного перемещения, можно определить, изменяя частоту внешнего переменного электрического поля. Когда эта частота превысит определенную величину, молекула белка больше не сможет быстро менять свое положение и не будет поэтому способствовать повышению диэлектрической постоянной раствора.
Время, необходимое для осуществления ориентации молекулы, которое получило название времени релаксации, сравнительно невелико для небольших молекул и велико для больших молекул. Для небольших молекул воды оно составляет приблизительно 10-11 сек., для молекул аминокислот — 10-10 сек., а для больших молекул белков от 10-8 до 10-6 сек. При частоте электрического поля, равной 103 гц (длина волны 3∙107 см), аминокислоты и белки вызывают описанное выше повышение диэлектрической постоянной. При частоте же, равной 107 гц (длина волны 3∙103 см) и выше, белки не вызывают повышения диэлектрической постоянной воды. В действительности обнаруживается даже небольшое понижение этой постоянной, так как некоторая часть воды, связанная белком, теряет способность следовать за колебаниями электрического поля [119].
Меняя частоту поля от высокой до низкой, можно установить ту критическую частоту, которая соответствует времени релаксации. Если эта критическая частота равна n, то время релаксации будет равно t = 1/2пn, а молекулярный объем будет равен VM = RTt/3η, где η — вязкость раствора. Если частица не имеет шарообразной формы, а представляет собой эллипс, то для времени релаксации находят не одно значение, а два. Одно значение соответствует времени поворота вокруг длинной оси, другое — вокруг короткой оси. Определение этих двух значений для времени релаксации позволяет вычислить отношение осей (a/b) молекул белков в их водном растворе. Найденные этим методом величины a/b для различных белков приводятся ниже (при расчете не принята во внимание гидратация белков) [121, 123, 125, 126]:

При вычислении приведенных выше величин было допущено упрощение, состоящее в том, что форма молекул рассматривалась как строго эллипсоидальная. Это, однако, далеко не всегда соответствует действительности. Так, например, молекула гемоглобина имеет форму цилиндра с слегка выпуклыми основаниями [2].
Диполи, изображенные на фиг. 28, представляют собой постоянные диполи. Надо указать, однако, что молекулы любых соединений, включая и типичные неполярные соединения, становятся диполями, если их поместить в электрическое поле. Это обусловлено смещением их электронов в направлении внешнего положительного полюса и таким же сдвигом ядер в направлении отрицательного полюса. Такого рода диполи, возникающие во внешнем электрическом поле, получили название индуцированных диполей. Суммарный дипольный момент молекул белков, как и дипольный момент молекул других соединений, включает в себя также момент индуцированных диполей.
До сих пор мы рассматривали белки как жесткие соединения с фиксированными дипольными моментами. Необходимо, однако, учитывать возможность того, что некоторые пептидные цепи внутри глобулярной молекулы белков обладают известной свободой и могут совершать колебательные или вращательные движения. В этом случае время релаксации их полярных элементов будет меньшим, чем время релаксации макромолекулы в целом [127]. Возможно, что некоторые из этих групп могут обусловить увеличение того прироста диэлектрической постоянной, который наблюдается при некоторых промежуточных частотах. В настоящее время мы не в состоянии еще точно определить распределение электрических зарядов внутри глобулярной молекулы белков. Хотя низкие величины прироста диэлектрической постоянной указывают на то, что заряды в молекуле распределены равномерно, все же имеется разница между зарядом поверхности глобулы белков и зарядом их внутренней части. Различия, доходящие до 0,78, были найдены между рНП (pH поверхности молекулы) и pH (pH внутренней массы молекулы) [128].
При исследовании реакций, происходящих между белками и другими макромолекулами, имеющими противоположный заряд, можно получить некоторые данные относительно распределения ионных групп между поверхностью и внутренней частью белковой молекулы. Так, например, было найдено, что глобулины образуют осадки при реакции с резко щелочными протаминами, растворенными в нейтральной среде. Альбумины при тех же условиях таких осадков не образуют [129]. На основании этих данных было сделано заключение, что у глобулинов отрицательно заряженные группы расположены на поверхности их молекул (экзогруппы), в то время как у альбуминов эти группы находятся внутри корпускулярных частиц (эндогруппы). Как экзогруппы, так и эндогруппы, могут реагировать с противоположно заряженными ионами, имеющими небольшой размер (например, с ионами водорода), но только экзогруппы могут реагировать с противоположно заряженными ионами большого размера. Этот метод дает, таким образом, возможность дифференцировать экзо- и эндогруппы.