Химия и биология белков - Ф. Гауровитц 1953
Внутренняя структура глобулярных белков
Оптические свойства белков
Исследование оптических свойств дает ценные данные для выяснения структуры органических соединений. В связи с этим были сделаны попытки изучить внутреннюю структуру белков при помощи определения показателей преломления, а также путем исследования вращения плоскости поляризации и спектров поглощения.
При рассмотрении вопросов, касающихся электрофореза белков, уже указывалось, что водные растворы белков обладают большим показателем преломления, чем вода, и что это обстоятельство может служить для определения положения подвижной границы при электрофорезе. Показатель преломления растворов белка линейно возрастает по мере увеличения концентрации белка в растворе. Разница между показателем преломления 1-процентного раствора белка и показателем преломления воды получила название удельного прироста преломления. Этот прирост слегка варьирует в зависимости от характера белка. Так, например, для сывороточного альбумина быка он равен 0,001901, для сывороточного альбумина человека — 0,001887, для яичного альбумина — 0,001876, для у-глобулинов человека — 0,001875 [106]. Температура и наличие в растворе солей не влияют заметным образом на удельный прирост преломления, поэтому концентрация белка в растворе может быть определена весьма быстро путем измерения показателя преломления раствора и вычитания из него показателя преломления диализата. Необходимо, однако, помнить, что прирост показателя преломления липопротеидов, равный 0,00171, значительно меньше, чем соответствующая величина для белков, не содержащих жиров [107].
Преломление, обусловленное молекулами органических соединений, представляет собой сумму преломлений их атомов. Это верно и в отношении белков. К сожалению, однако, это обстоятельство не может быть использовано для изучения структуры белков, так как содержание углерода, азота, водорода и кислорода в различных белках почти одинаково. Кроме того, число отдельных атомов в молекуле белка настолько велико, что участие одного атома или группировки атомов в общем преломлении молекулы ничтожно мало. Те же соображения относятся и к способности белков вращать поляризованный луч света [108, 109]. Поскольку все аминокислоты, за исключением глицина, являются оптически активными соединениями и асимметрические атомы углерода аминокислот остаются асимметрическими и в пептидной цепи, полипептиды и белки представляют собой оптически активные соединения. Знак и величина удельного вращения белка зависят от числа аминокислот в белке и от их строения. Общая величина, получающаяся в результате взаимодействия сотен молекул аминокислот, не позволяет поэтому сделать какие-либо выводы относительно расположения аминокислот и относительно других деталей, касающихся внутренней структуры белка. Удельное вращение белков достигает минимума в их изоэлектрической точке. Оно колеблется между —30 и —70° [109]. Значительно большие величины, вплоть до —313°, были обнаружены в желатиновых гелях [110].
Некоторые данные относительно структуры белков были получены при исследовании их спектров поглощения в различных областях спектра. Видимые лучи света поглощаются только окрашенными белками, такими, как гемоглобин, желтый фермент, зрительный пурпур и другие хромопротеиды. Определение спектров поглощения в видимом свете позволило получить весьма ценные сведения относительно структуры окрашенных простетических групп этих белков, однако такие определения ничего не могут дать для суждения о структуре их бесцветного белкового носителя.
Все белки обнаруживают ясный спектр поглощения в ультрафиолетовом свете. Максимум поглощения лежит около 270 mμ [111, 112]. Этот максимум соответствует максимуму поглощения триптофана, фенилаланина и тирозина. По интенсивности спектра поглощения в ультрафиолетовом свете можно поэтому судить о содержании указанных аминокислот в различных белках. Гидролиз белков протеолитическими ферментами заметно не отражается на характере их спектра поглощения (фиг. 27) [113]. На этом основании можно сделать вывод, что в нативных белках нет таких специфических, поглощающих свет структур, которых не было бы в гидролизате. Тем самым опровергается и предположение некоторых авторов о наличии в нативных белках значительного числа гетероциклических колец.
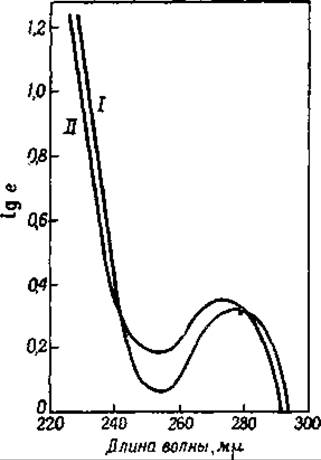
Фиг. 27. Спектры поглощения сывороточного глобулина и гидролизата этого белка, полученного под действием трипсина [113].
I — сывороточный глобулин; II — гидролизат.
Поглощение в инфракрасном свете обусловлено определенными группировками атомов. При исследовании поглощения в инфракрасном свете большим затруднением является то, что вода также обнаруживает поглощение в этой области спектра. В связи с этим приходится производить исследования, пользуясь сухими белковыми пленками, которые никогда не бывают совершенно однородными и, кроме того, отличаются друг от друга по толщине и имеют трещины. Все эти факторы сильно осложняют определение интенсивности поглощения в инфракрасном свете и значительно уменьшают точность определений. Несмотря на эго, все же удалось получить типичные максимумы поглощения в инфракрасной
области для ряда белков. Максимумы при 3 μ и 3,22 μ обусловлены группами NH пептидной связи, а максимум при 6 μ группами СО. Нет пока никаких указаний на то, что энолизованные пептидные связи —C(OH)=N— могут поглощать в инфракрасном свете [114]. При определении интенсивности поглощения волокна шелка в области λ = 1,90 μ было обнаружено, что полоса поглощения более ясно выражена в направлении, перпендикулярном к длинной оси волокна. На этом основании было высказано предположение, что группы СО в волокне шелка расположены перпендикулярно к этой оси [116, 117]. Анализ же белков в поляризованном инфракрасном свете привел к заключению, что группы NH расположены параллельно длинной оси волокна [115].