Химия и биология белков - Ф. Гауровитц 1953
Альбумины, глобулины и другие растворимые белки
Белки сыворотки крови
Белки сыворотки крови принадлежат к числу наиболее изученных белков, поэтому мы рассмотрим эту группу белков в первую очередь. Они представляют собой также первую группу белков, которая была фракционирована при помощи высаливания сернокислым аммонием [7] и сернокислым магнием [8]. Позднее для этой же цели были предложены сернокислый натрий [9] и фосфатный буфер при различных значениях pH [10]. Если на оси ординат отложить количество осажденного белка, а на оси абсцисс — концентрацию соли, то получается кривая, подобная изображенной на фиг. 33. Анализ этой кривой показывает, что при некоторых концентрациях соли количество осаждаемых белков резко увеличивается. Это явление свидетельствует о том, что в плазме имеется несколько различных белков. Первым белком крови, осаждающимся из плазмы при добавлении нейтральной соли, является фибриноген (часть Ф на кривой высаливания). Этот белок обладает характерными особенностями, и поэтому мы рассмотрим его детальнее в другом разделе. Следующая часть кривой (Г) соответствует зоне осаждения глобулинов сыворотки и последняя часть (А) — зоне осаждения сывороточного альбумина. Если для осаждения белков применяется сернокислый магний, то глобулины осаждаются при полном насыщении раствора, а альбумины — при доведении pH раствора до 4,6—изоэлектрической точки альбуминов.
При рассмотрении вопросов, касающихся электрофореза белков (см. гл. V), уже упоминалось, что фракция сывороточного глобулина представляет собой смесь, по крайней мере, трех компонентов, обозначаемых как a-, ß- и у-глобулины [11]. Если к сыворотке крови лошади осторожно добавлять сернокислый аммоний, то при концентрации 1,34 моль/л осаждаются у-глобулины; ß-глобулины осаждаются при концентрации 1,64 моль/л, d-глобулины — при концентрации 2,05 моль/л, наконец, альбумины — при концентрации 2,57 моль/л [12]. Для получения больших количеств глобулинов этот метод удобнее электрофоретического; получаемые отдельные фракции содержат, однако, некоторое количество примесей белков других смежных фракций. Сернокислый аммоний в качестве осадителя обладает и еще одним недостатком: он содержит азот, что делает невозможным прямое определение азота в выделенных белках по методу Кьельдаля. Поэтому в клинике для количественных определений альбуминов и глобулинов в сыворотке крови вместо сульфата аммония пользуются сернокислым натрием [9].
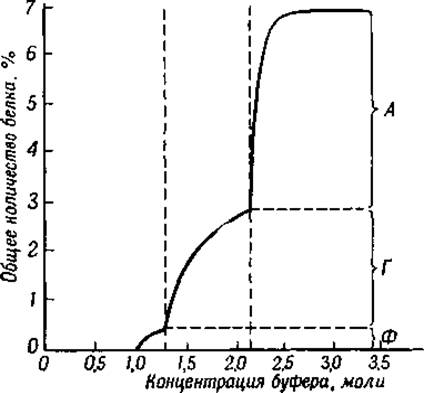
Фиг. 33. Высаливание белков плазмы крови человека растворами фосфатного буфера при pH. 6,5.
A — альбумин; Г — глобулин; Ф — фибриноген.
Сернокислый натрий осаждает глобулины сыворотки при концентрации 21,5%, альбумины же определяются в фильтрате после удаления глобулинов. Осаждение и фильтрование проводятся при 37°, так как сернокислый натрий недостаточно растворим при комнатной температуре. Недавно, однако, было обнаружено, что при фракционировании белков сыворотки указанным методом значительные количества a-глобулинов остаются во фракции альбуминов. В связи с этим было предложено повышать концентрацию сернокислого натрия до 26,8%, так как при этой концентрации a-глобулины осаждаются полностью; ß- и у-глобулины осаждаются при концентрации сернокислого натрия 19,6% [13].
Метод высаливания белков нейтральными солями благодаря своей простоте и доступности нашел широкое применение в лабораторной практике. Для получения больших количеств белковых фракций плазмы он, однако, непригоден, так как на удаление солей путем диализа требуется слишком много времени и труда [14]. Поэтому Кон и его сотрудники разработали новый метод разделения белков плазмы, используя в качестве осадителя этиловый спирт [15]. Во избежание денатурирования белков спиртом, осаждение белков по этому методу проводится при низких температурах. Спирт легко удаляется при высушивании белков в замороженном состоянии под вакуумом или путем диализа. Осаждающее действие спирта обусловлено главным образом низкой диэлектрической постоянной смеси спирт — вода по сравнению с диэлектрической постоянной воды. Известно, что силы электростатического притяжения и отталкивания обратно пропорциональны диэлектрической постоянной среды, поэтому понижение этой постоянной способствует взаимодействию белковых молекул и образованию агрегатов. Противоположный эффект — увеличение растворимости белков — наблюдается при добавлении глицина, повышающего диэлектрическую постоянную воды (см. гл. VII). Растворимость белков в воде или в водно-спиртовых смесях зависит также от температуры, от концентрации водородных ионов и от ионной силы раствора. Варьируя все эти факторы, Кон, Эдсалл и Онклей получили из плазмы крови большое количество отдельных белковых фракций, а также выделили ряд биологически активных белков, в частности ферменты и антитела. На фиг. 34 представлены наиболее важные результаты, полученные при фракционировании белков этим способом. Ниже приводится схема фракционирования белков плазмы, применяемая в Гарвардской лаборатории [4, 16].
Фракция I осаждается при добавлении этилового спирта до 8—10%, при pH 7 и температуре от 0 до —3°. Она содержит60—65% фибриногена (см. следующий раздел) и может быть использована для получения фибриновых пленок.
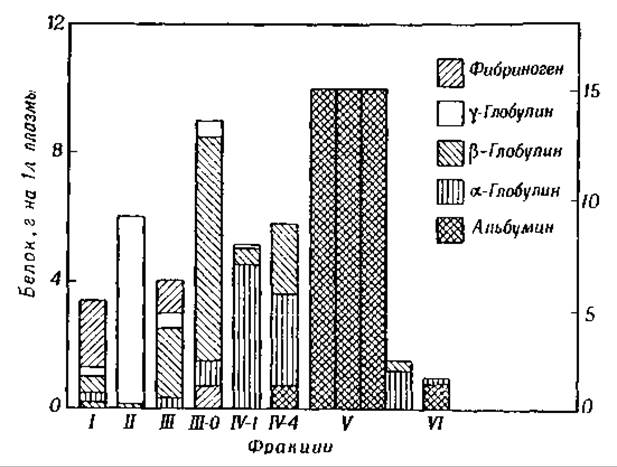
Фиг. 34. Распределение отдельных белков в электрофоретических фракциях плазмы крови человека. Шкала справа указывает содержание каждой фракции в процентах от общего количества белка в плазме [24].
Фракции II и III осаждаются при повышении концентрации этилового спирта до 25% и понижении температуры до —5°; дальнейшее разделение этих фракций проводится путем понижения концентрации этилового спирта до 20%; фильтрат (фракция III-0) содержит β1-глобулин и β1-липопротеин (см. гл. XI), тогда как в осадке находятся у-глобулин, протеолитические ферменты, «средняя часть» комплемента (см. стр. 348), протромбин (см. ниже) и изоагглютинины; при pH 5,2 и концентрации спирта 17% осаждаются все вышеперечисленные белки (фракция III), кроме у-глобулинов. Из фильтрата (фракция II) у-глобулины осаждаются при повышении ионной силы раствора до 0,05. Из протеолитических ферментов во фракции II найдены ферменты, обладающие способностью растворять сгусток фибрина. Ферменты плазмин, плазминоген (фракция III-3) и протромбин (фракция III-2) осаждаются при конечной концентрации этилового спирта 1 %, pH 5,4 к ионной силе 0,08. Изоагглютинины (анти-А и анти-В агглютинины, реагирующие с кровью групп А и В. а также анти-Rh агглютинины) остаются в растворе (фракция ІІІ-1). Во фракции ІІІ-1 содержатся также 0-агглютинины (против тифа) и некоторая часть дифтерийного антитоксина. Самой важной фракцией является фракция II, состоящая почти целиком из у-глобулина. Эта фракция имеет большое значение для клиники, так как она содержит антитела против возбудителей кори, инфекционных гепатитов и других заразных болезней. Основная часть дифтерийного антитоксина сосредоточена во фракциях II-1 и II-2 [16].
Фракция IV-1 осаждается при понижении концентрации этилового спирта до 18% и pH до 5,2. Она состоит из а-глобулинов; в ней найден липопротеин [17], содержащий около 35% липидов (холестерин, жирные кислоты и фосфолипиды) (см. гл. XI), а также сине-зеленый пигмент.
Фракция IV-4 осаждается при повышении концентрации этилового спирта до 40% и pH до 5,8. Фракция содержит а- и ß-глобулины без примесей липидов и некоторое количество альбумина (IV-8), Часть глобулинов этой фракции обладает биологически активными веществами. К их числу принадлежат эстераза, пептидаза, фосфатаза и тиреотропный гормон. Во фракции IV находятся глобулины, связанные с углеводами (а2-глюкопсевдоглобулин и а2-мукоглобулин), и ß-глобулин, обладающий способностью легко соединяться с тяжелыми металлами. Этот ß-глобулин состоит из двух компонентов: один обладает способностью связываться с железом, другой — с медью [18]. Железосодержащий белок, получивший название трансферрина или сидерофилина, участвует, по-видимому, в транспорте железа в организме (см. гл. XI). Молекулярный вес трансферрина 90 000, а молекулярный вес церулоплазмина, содержащего медь, 150 000 [19].
Фракция V осаждается при понижении pH до 4,8 при помощи ацетатного буфера (концентрация спирта поддерживается все время неизменной — 40%). Эта фракция содержит большую часть сывороточного альбумина, который молено получить в виде кристаллов [20]. Жидкость, слитая с осадка от фракции V (фракция VI), содержит небольшие количества альбумина и а-глобулина.
В плазме крови человека содержится около 6,5—7,0% белка; примерно 50% этого общего количества составляет альбумин, 15% а-глобулин, 19% — β-глобулин, 11% — у-глобулин и 5% — фибриноген [4, 21, 22]. Метод ультрацентрифугирования дает, однако, более высокие цифры для альбумина, чем метод электрофореза [23]. В табл. 12 приводятся данные о содержании наиболее важных белковых фракций в плазме и о молекулярных весах соответствующих белков. Размеры молекул вычислены [24], исходя из предположения о том, что количество гидратной воды составляет 0,2 г на 1 г белка (для шарообразных ß1-глобулинов — 0,6 г).
Таблица 12 Белковые фракции плазмы
|
Фракции |
Содержание в плазме, % |
Молекулярный вес |
Приблизительные размеры [24] молекул, Å |
|
Альбумин |
3,2 |
69 000 |
150X38 |
|
a1-Глобулин |
0,2 |
200 000 |
300X50 |
|
а2-Глобулин |
0,1 |
300 000 |
— |
|
β1-Глобулин |
0,2 |
90 000 |
190X37 |
|
β1-Глобулин |
0,2 |
150 000 |
— |
|
β1-Глобулин |
0,1 |
500000—1 000 000 |
— |
|
β1-Глобулин |
0,2 |
1 300 000 |
185X185 |
|
β2-Глобулин |
0,2 |
150 000 |
— |
|
у-Глобулин |
0,5 |
156 000 |
235X44 |
|
у-Глобулин |
0,1 |
300 000 |
— |
|
Фибриноген |
0,3 |
400000 |
700X38 |
Данные относительно изоэлектрических точек и электрофоретической подвижности некоторых фракций приводятся в табл. 13 [11]. Величины подвижностей при pH 7,7 вычислены для 1-процентных растворов очищенных фракций при 0° и при ионной силе 0,2.
Таблица 13 Изоэлектрические точки и электрофоретические подвижности некоторых белковых фракций плазмы
|
Белок |
Изоэлектрическая точка pH |
Подвижность при pH 6,87, 10-5 см2/в∙сек |
Подвижность при pH 7,7,10-5 см2/в∙сек |
|
Альбумин |
4,64 |
5,90 |
4,1 |
|
а-Глобулин |
5,06 |
4,48 |
3,8 |
|
β-Глобулин |
5,12 |
3,58 |
2,7 |
|
1-Глобулин [25] |
6,85—7,3 |
0,99 |
0,9 |
|
Фибриноген |
1,9 |
Следует указать, что белки, полученные как при фракционированном осаждении, так и при помощи электрофореза, не являются полностью однородными соединениями. Так, например, было найдено, что кристаллический сывороточный альбумин лошади содержит 10% глюкопротеида, носящего название сероглюкоида, и, кроме того, глобулин глобоглюкоид [26, 27]. Альбумин, очищенный от всех этих примесей, называют собственно кристаллическим альбумином. у1-Глобулин и у2-глобулин, которые на основании электрофоретических исследований считались однородными веществами [28], оказались, однако, неоднородными при исследовании в ультрацентрифуге [29]; у1-глобулин, очевидно, идентичен ß1-глобулину, который был найден некоторыми авторами, и Т-компоненту, обнаруженному в некоторых иммунных сыворотках [30]. Изоэлектрические точки двух фракций у-глобулина из сыворотки человека находятся при pH 6,85 и 7,3 [25]; изоэлектрические точки аналогичных фракций из сыворотки быка — при pH 5,85 и 7,35 [31]; путем комбинированного применения электрофореза и электродекантации f-глобулин из сыворотки быка был разделен на восемь фракций [32].
Необходимо указать, что кроме этилового спирта для осаждения белков применяются и другие органические растворители, например метиловый спирт [33] или смесь метилового спирта с метилалем (СН3ОСН2ОСН3) [34].
Недавно для фракционирования белков плазмы крови начали применять также соли тяжелых металлов, в частности соли цинка [35]. Осаждение белков большими количествами солей тяжелых металлов приводит к необратимой их денатурации, прибавление же небольших количеств солей вызывает обратимое связывание катионов белками (по всей вероятности, сульфгидрильными группами белка) с образованием осадков, из которых можно выделить нативный белок [35].
В настоящее время трудно еще интерпретировать результаты, получаемые при фракционированном осаждении белков плазмы. Мы не можем еще с достаточной уверенностью сказать, существуют ли все эти фракции как таковые в самой плазме крови, а также решить вопрос о возможности их дальнейшего разделения. Всего вероятнее, что белки плазмы находятся в плазме в виде соединений с липидами, углеводами, а также друг с другом1. Так, например, можно думать, что у-глобулины, изоэлектрическая точка которых лежит около pH 7,0, дают солеобразного типа соединения с альбуминами, изоэлектрическая точка которых находится вблизи pH 4,7. Возможно также, что белковые компоненты липопротеинов и глюкопротеидов плазмы идентичны некоторым белкам, выделенным из плазмы крови при фракционированном осаждении. Различия в электрофоретической подвижности белков и их осаждаемости могут зависеть также от образования обратимых комплексов с бикарбонатом [36], кальцием и с другими ионами. Следует также помнить, что спирт или соли, применяемые для осаждения белков, могут влиять на физико-химические свойства этих последних. При добавлении спирта или концентрированных растворов солей возможно как образование новых комплексов, так и расщепление существующих соединений.
1 В работе Г. В. Троицкого (Биохимия, 15, 426, 1950) показано, что ß-глобулины сыворотки крови очень легко образуют соединения с каротином и витамином А, причем при электрофоретическом разделении белков как каротин, так и витамин А остаются соединенными с ß-глобулинами.— Прим. ред.
Время от времени в литературе появляются сообщения о превращениях альбумина в глобулин при воздействии различных реагентов, например смеси этилового спирта с диэтиловым эфиром, гепарина и некоторых других соединений. Само собой разумеется, что речь идет не о подлинном превращении; такое превращение было бы невозможно, так как альбумины по своему аминокислотному составу отличаются от глобулинов (см. табл. 1). Речь может идти только о том, что при определенных экспериментальных условиях растворимость альбумина изменяется, в результате чего он по своим физико-химическим свойствам становится похожим на глобулин. Поэтому вполне возможно, что в нативной плазме крови имеется лишь небольшое количество белков и что многие из выделенных белковых фракций образованы путем соединения этих основных белков с липидами, углеводами, друг с другом, а также с некоторыми ионами.
С другой стороны, мы должны признать, что усовершенствование методов фракционирования белков позволило установить присутствие в плазме большого числа новых белковых фракций. Прежние представления о том, что в плазме крови содержится только один альбумин и один глобулин, пришлось оставить и признать, что в ней имеются а-, ß- и у-глобулины, причем каждая из этих фракций, в свою очередь, может быть разделена на две подфракции и более. Путем дальнейшего усовершенствования методов можно, очевидно, получить из плазмы еще большее количество белковых фракций. Возможно, что в плазме крови вообще нет совершенно чистых однородных белков. Иммунологические исследования показали, что при инъекции антигена в крови появляется ряд специфических глобулинов (антител), обладающих различной способностью реагировать с полярными группами антигена [37]. Возможно, что так же обстоит дело и с нормальными сывороточными глобулинами, т. е. что в нормальной плазме содержатся различные типы глобулинов, между которыми существуют промежуточные формы. Если это так, то безнадежны все попытки выделить совершенно однородные глобулины из плазмы крови.
В литературе имеется много данных относительно характерных изменений белковой картины плазмы при различных заболеваниях [5]. Так, например, при заболеваниях почек часто наблюдается уменьшение содержания белков в плазме вследствие потери сывороточного альбумина через почки. В этих случаях уменьшается не только общее количество белка, но уменьшается также и отношение альбумины/глобулины. Так как осмотическое давление альбуминов в связи с их небольшим молекулярным весом значительно выше, чем осмотическое давление глобулинов, то при понижении содержания альбуминов в плазме заметно уменьшается общее осмотическое давление белков сыворотки. Выраженная гиперпротеинемия — явление гораздо более редкое, чем гипопротеинемия. Она наблюдается у больных с миеломой и характеризуется увеличением количества глобулинов в плазме. В моче некоторых больных с миеломой найден специфический белок, получивший название белка Бенс-Джонса. Белок Бенс-Джонса выпадает в осадок при нагревании мочи до 50—58°, но растворяется при дальнейшем нагревании. Это явление обратимо: при охлаждении мочи вновь появляется осадок, который растворяется при дальнейшем понижении температуры. Белок с подобными же свойствами был обнаружен в плазме крови больных лимфосаркомой [38]. Этот белок был назван криоглобулином. Белок Бенс-Джонса, подобно вирусным белкам, не содержит метионина [39], но отличается от вирусных белков своим значительно более низким (35 000) молекулярным весом [40]. Возможно, что белок Бенс-Джонса представляет собой продукт расщепления вирусного белка. Гиперглобулинемия наблюдается также при инфекционных заболеваниях, однако в этих случаях она менее выражена, чем при миеломе. Увеличение количества антител в организме инфекционных больных обычно сопровождается увеличением содержания глобулинов в сыворотке.
Изменения в белковой картине плазмы можно обнаружить электрофоретическим путем. Электрофоретические диаграммы отражают не только увеличение общего количества белка в плазме или количества альбуминов и глобулинов, но и изменения в соотношении количества альбуминов и глобулинов или появление ненормального типа белков [41].
Существует несколько простых методов, при помощи которых в клинике можно быстро обнаружить изменения в количественных соотношениях белковых фракций плазмы [5]. Одним из этих методов служит метод Таката—Ара: к испытуемой сыворотке прибавляется раствор хлористой ртути и углекислого натрия и определяется способность сыворотки препятствовать осаждению ртутной соли углекислым натрием. Чем выше отношение альбумины/глобулины, тем выше эта «защитная» способность сыворотки. Эта реакция положительна при некоторых болезнях печени.
Другим методом является тимоловая проба [42]. Сыворотка смешивается с барбитуровым буфером (pH 7,8), насыщенным тимолом. Нормальная сыворотка при этом остается прозрачной, у больных же с заболеванием печени сыворотка часто мутнеет. Это помутнение обусловлено увеличением содержания в сыворотке у-глобулинов, фосфолипидов и холестерина. В нормальной сыворотке количество альбуминов достаточно, чтобы воспрепятствовать появлению мути [43, 44].
Как видно из изложенного, в этих клинических методах использовано свойство альбумина препятствовать образованию осадка или мути. Это свойство присуще только альбуминам, но не глобулинам. «Защитное» действие альбумина обусловлено наличием на поверхности его молекул большого числа отрицательно заряженных групп, а также способностью альбумина легко соединяться с анионами (см. стр. 221). Молекулы сывороточного альбумина, изоэлектрическая точка которого лежит примерно при pH 4,7, имеют при pH 7,0 большой избыток отрицательно заряженных групп. Число ионных групп в молекуле глобулина при этом значении pH гораздо меньше, так как изоэлектрическая точка этого белка лежит примерно при pH 6,0.
Данные, полученные на сыворотке человека, нельзя целиком переносить на сыворотку других животных. У разных видов животных содержание в сыворотке альбуминов и различных типов глобулинов колеблется в широких пределах [45]. Отмечены также и возрастные особенности. Плазма новорожденных животных, как правило, содержит мало глобулинов; так, например, в плазме новорожденного жеребенка содержится 3,7% белка, причем на долю альбумина приходится 65%, а-глобулина — 32%, β-глобулина — 3%, у-глобулина — 0%. Плазма же 10-летней лошади содержит 7% белка, из которого на долю альбумина приходится 30%, а-глобулина —11%, ß-глобулина —12% и у-глобулина — 47%. Приведенные цифры показывают, что в плазме новорожденного жеребенка совершенно нет у-глобулинов, а содержание а- и ß-глобулинов значительно меньше, чем в плазме взрослой лошади [46]. Плазма новорожденного кролика содержит только 0,2% глобулинов и 4,8% альбумина [47].
В сыворотке новорожденного теленка был найден, однако, низкомолекулярный специфический глобулин, так называемый фетуин, который составляет около 90% всех глобулинов плазмы теленка [21]. Молекулярный вес этого белка — 50 000; высаливание его происходит при насыщении раствора сернокислым аммонием на 35—45%. В плазме Petromyzon marinus L. был также найден специфический глобулин с молекулярным весом 34 000 [48].