Химия и биология белков - Ф. Гауровитц 1953
Альбумины, глобулины и другие растворимые белки
Мышечные белки (сократимые белки)
Мышцы позвоночных животных содержат приблизительно 15—20% белка, большая часть которого может быть экстрагирована при обработке растертой с песком свежей мышцы разведенными растворами солей. Если с момента смерти животного прошло некоторое время, то часть растворимых мышечных белков переходит в нерастворимое состояние, что отражается на количестве экстрагируемых вышеуказанным путем белков. Чтобы избежать этого превращения растворимых белков в нерастворимые, необходимо, во-первых, обрабатывать мышцы сразу же после умерщвления животного и, во-вторых, вести экстракцию при низких температурах.
Водные экстракты мышц содержат следующие белковые фракции: миоген, миозин, глобулин X и белки стромы. Из перечисленных белков миоген обладает наибольшей растворимостью. Миозин выпадает в осадок при разбавлении экстрактов водой, когда концентрация КСl в растворе падает до 0,03 М (0,22%). При дальнейшем разбавлении экстрактов водой (до концентрации 0,005 М КСl) выпадает в осадок глобулин X [86]. Миозин составляет приблизительно 40% всех белков мышц; остальные 60% белков распределяются приблизительно поровну между миогеном, глобулином X и белками стромы [86].
Миоген, считавшийся в течение долгого времени однородным белком, на самом деле представляет собой смесь, по крайней мере, трех белков — миогенов А, В и С [87]. Все три миогена получены в кристаллическом виде при помощи дробного высаливания сернокислым аммонием при 60-, 80- и 96-процентном насыщении [87, 88]. Средний молекулярный вес миогена, равный 81 000, при обработке мочевиной уменьшается до 34 000 [86]. По растворимости (для высаливания миогена требуются высокие концентрации сернокислого аммония) миоген относят к альбуминам. В растворах миогена, хранящихся при комнатной температуре, часть миогена свертывается и переходит в нерастворимое соединение, получившее название миогенфибрина. Фракция миогена содержит многие ферменты мышц. Так, в этой фракции обнаружены фосфорилаза, фосфоглюкомутаза, альдолаза1 и дегидраза глицероальдегидфосфата [89]. Эти ферменты составляют, по крайней мере, 20—25% всего количества миогена.
1 Альдолазная активность миогена была установлена В. А. Энгельгардтом и его сотрудниками еще в 1939 г. (Усп. совр. биол., XIV, 177, 1941). Согласно данным М. М. Заалишвили, альдолазная активность связана с той фракцией миогена, которая выделяется в виде миогена А. Миоген А не содержит свободных сульфгидрильных групп; содержание свободных аминогрупп равно 0,9%, а карбоксильных —1,85% общего количества белка. Ультрафиолетовый спектр поглощения миогена А имеет максимум при 278 mμ. Этот максимум не смещается при реакции миогена А с гексозодифосфатом, следовательно, соединение фермента с субстратом происходит не через те группировки, которые обусловливают характер ультрафиолетового спектра. — Прим. Ред.
Миозин, наиболее важный белок мышц, считается сократимым веществом мышцы. Миозин можно получить из мышцы экстракцией раствором Вебера (0,6 М КСl, 0,04 М NaHCO3,
0,01 М Na2CO3). Растворы миозина обладают высокой вязкостью и проявляют очень резко выраженное двойное лучепреломление в потоке (см. стр. 57) [90]. При стоянии растворов миозина образуется гель, который при встряхивании разжижается; это явление тиксотропии наблюдается даже в 0,3-процентных растворах миозина [90]. Двойное лучепреломление растворов миозина сильно снижается при добавлении веществ, понижающих вязкость растворов, например хлористого кальция, йодистого калия, гуанидина и многих других [91]. При продавливании солевых растворов миозина через узкое отверстие в дестиллированную воду образуются тонкие нити миозина [92].
Из всего сказанного следует, что, повидимому, молекулы миозина имеют в растворе форму удлиненных нитевидных частиц. Данные физико-химического анализа сухого миозина подтверждают этот вывод. При помощи электронной микрографии в сухом препарате миозина были обнаружены нити длиной примерно 1 000 mμ и толщиной 5—10 mμ [93]. Рентгеноструктурный анализ миозина показал, что период идентичности вдоль оси волокна составляет 726 Å, а период идентичности в поперечном направлении волокна равен 200—325 Å [94]. Кроме указанных были обнаружены также периоды идентичности в поперечном направлении, равные 66, 42 и 33 Å; период в 66 Å рассматривается как поперечный диаметр единичного волокна миозина [95]. Наличие вдоль оси волокна коротких периодов идентичности (равных 2,82 Å) дает основание предположить, что главные пептидные цепи миозина образуют спирали вокруг своей длинной оси и что боковые цепи тесно связаны друг с другом [96]. Молекулярный вес миозина очень высок; для препаратов, полученных различными методами, были найдены значения от 600 000 до 3 900 000 [86, 97].
Сочетая метод электрофореза с методом высаливания сернокислым аммонием, можно получить три различные фракции миозина, названные a-, ß- и у-миозином. Фракция a-миозина осаждается из раствора при 23—27-процентном насыщении сернокислым аммонием, фракция ß-миозина — при 35—39-процентном насыщении [98]. Двойным лучепреломлением в потоке обладают только растворы миозина [98].
При длительном экстрагировании мышцы раствором Вебера в раствор переходит миозиноподобный белок, обладающий гораздо большей вязкостью, чем миозин, получаемый при кратковременном экстрагировании [99]. Этот белок оказался сложным соединением, состоящим из миозина и второго белка, названного актином. Для получения актина мышца сначала экстрагируется в течение короткого времени водой, а затем ацетоном, после чего сухой остаток вновь экстрагируется водой. Этот последний экстракт и содержит актин [100]. Из 1 г свежей мышцы можно получить приблизительно 80 мг миозина и 20—30 мг актина. Актин легко соединяется с миозином, образуя актомиозин (миозин В). Отношение миозина к актину в актомиозине равно примерно 5:2 [101, 102]. Актомиозин идентичен белку, который был описан под названием миозина. Некоторые исследователи предлагают поэтому актомиозин, открытый Сент-Джиордьн, называть миозином, а белок, который Сент-Джиордьи назвал миозином, называть миозином (в. р.), т. е. водорастворимым миозином [102].
Актин существует в двух формах: фибриллярной (Ф-актин) и глобулярной (Г-актин) [99]. С миозином может соединяться, образуя актомиозин, только Ф-актин, который получается из Г-актина при обработке последнего хлористым калием [99, 103]. Нити Ф-актина могут переходить в Г-актин также под действием ультразвука [104, 105]1.
Актин соединяется только с а-миозином и не реагирует с ß- и у-миозином [98]. Вещества, обладающие способностью связывать свободные сульфгидрильные группы (например, моноиодуксусная кислота), тормозят образование актомиозина из его компонентов. На этом основании было высказано предположение, что при образовании актомиозина актин соединяется с сульфгидрильными группами миозина [1061 Растворы актомиозина, так же как и растворы миозина, обнаруживают резко выраженное двойное лучепреломление в потоке; растворы же актина не обладают этим свойством [107].
Помимо миозина, мышцы содержат 0,5% тропомиозина — белка, очень близкого по свойствам к миозину [108]. Для получения тропомиозина мышцы экстрагируются последовательно водой, 50-процентным этиловым спиртом, 97-процентным этиловым спиртом и диэтиловым эфиром; тропомиозин получается из оставшегося сухого порошка путем экстракции 1 М раствором хлористого калия. Аминокислотный состав тропомиозина почти не отличается от аминокислотного состава миозина (см. табл. 1). Оба белка содержат необычайно большие количества лизина — аминокислоты с ясно выраженными основными свойствами (около 17%). Тропомиозин дает очень вязкие растворы; его молекулярный вес в фосфатном буфере равен 135 000; при добавлении хлористого натрия тропомиозин распадается на частицы с молекулярным весом 65 000 [113]. Поскольку обе эти величины значительно ниже молекулярного веса миозина, предполагают, что миозин является продуктом полимеризации тропомиозина [108]. Высокая вязкость растворов тропомиозина обусловлена, как показали данные элекгрономикроскопии, асимметрической формой его молекул [109], постоянная диссимметрии которых равна f/f0 = 3 [110].
1 Недавно в литературе появились данные относительно аминокислотного состава актина. В работе И. И. Иванова и Е. Н. Асмоловой (Биохимия, 15, 201, 1950) приводятся следующие цифры для отдельных аминокислот (в процентах от общего содержания азота в актине): аргинин 14,2—14,6; аспарагиновая кислота 5,85; глутаминовая кислота 9,3; гистидин 4,0; лизин 10,25; триптофан 1,7—1,9; фенилаланин — следы; тирозин 2,1; метионин 2,4—2,95; цистин 0,81—0,83.
В процентах от веса белка содержание отдельных аминокислот в актине, выделенном из мышц кролика, характеризуется следующими цифрами:
|
Аргинин |
7,2 |
Метионин |
4,6 |
|
Лизин |
8,55 |
Гликокол |
6,9 |
|
Гистидин |
2,4 |
Аланин |
1,7 |
|
Глутаминовая кислота |
15,5 |
Валин |
2,8 |
|
Аспарагиновая кислота |
8,0 |
Пролин |
7,1 |
|
Тирозин |
1,3 |
Оксипролин |
1,66 |
|
Триптофан |
2,1 |
Лейцин и изолейцин |
22.3 |
|
Цистин |
1,1 |
Фенилаланин |
0 |
Прим. ред.
На миозин и актомиозин совершенно специфическое влияние оказывает аденозинтрифосфорная кислота [АТФ] — мононуклеотид, присутствующий в мышечной сыворотке. Добавление АТФ к растворам миозина или актомиозина вызывает резкое падение высокой вязкости этих растворов; исчезает и способность этих растворов к двойному лучепреломлению в потоке [111, 112]. Это связано с тем, что при взаимодействии с АТФ длинные актомиозиновые нити скручиваются, образуя глобулярные частицы комплекса актомиозин — АТФ [103, 121]. В комплексе актомиозин — АТФ соотношение молекул актина, миозина и АТФ равно 1:1:1 [115]. Искусственные нити соединения актомиозина с АТФ получают путем выдувания растворов этого комплекса через узкие отверстия в дестиллированную воду. Эти нити сокращаются примерно до 50—60% своей первоначальной длины при их обработке 0,01 М раствором хлористого калия [112].
Электронные микрограммы поперечнополосатой мышцы показали, что актомиозиновые волокна проходят, не прерываясь, через ее изотропные и анизотропные диски [102]. Эти волокна, по-видимому, являются сократимым веществом покоящейся мышцы [115, 116].
В 1939 г. Энгельгардт и Любимова [117] открыли, что аденозинтрифосфорная кислота расщепляется миозином или белком, неотделимым от миозина существующими способами очистки. При этой реакции аденозинтрифосфорная кислота превращается в аденозиндифосфорную кислоту (АДФ) [105]. При помощи ультрафиолетовой микроскопии было показано, что АДФ сосредоточена главным образом в изотропных дисках [118]. Недавно было установлено, что аденозинтрифосфатазу можно отделить от миозина [119, 120]1.
В настоящее время большинство исследователей считает, что в основе мышечного сокращения лежит деформации миозиновых молекул. Это следует из уменьшения двойного лучепреломления. Во-время изотонического сокращения мышцы [83]. Двойное лучепреломление в покоящейся мышце обусловлено параллельным расположением молекул миозина, и, следовательно, уменьшение двойного лучепреломления свидетельствует о нарушении этого ориентированного расположения миозиновых цепей. Рентгеноструктурный анализ не обнаруживает, однако, каких-либо заметных изменений при сокращении мышцы; во-время сокращения главный период идентичности (725 А) остается без изменений [121]. Возможно, что при сокращении молекулы миозина вновь получают правильную ориентацию вследствие поперечного скручивания [122] или в результате сверхсокращения по типу сверхсокращения кератиновых волокон [123] (см. гл. IX).
Согласно одной из существующих гипотез, молекула актомиозина состоит из нитей миозина и актина, соединенных друг с другом боковыми поверхностями. Поскольку миозин способен сокращаться, а актин не обладает этой способностью, сокращение одного миозина должно привести к искривлению всего актомиозинового волокна [127] (фиг. 36). Согласно другому взгляду [124, 126], мышечное сокращение происходит в результате соединения «конец с концом» небольших глобул актина с молекулярным весом 70 000; при этом образуются нити актина с молекулярным весом і 500 000, обладающие способностью соединяться с нитями миозина [124]. При сокращении акюмиозин вновь распадается на свои компоненты [125].
1 Кроме аденозинтрифосфатазной активности, миозин обнаруживает также способность дезаминировать адениловую кислоту. Это было установлено Д. Л. Фердманом и И. С. Нечкпоренко в 1946 г. (Укр. биохим. журн 18, 105, 1946). Эта способность сохраняется у миозина даже после многократной его перекристаллизации. В связи с установлением этого факта возник вопрос о том, принадлежит ли аденозинтрифосфатазная и дезаминазная активность препаратов миозина двум различным белкам, находящимся в препаратах миозина, или же в этом случае мы имеем дело с одним белком, обладающим одновременно обеими активностями. Этот вопрос был подвергнут исследованию В. А. Энгельгардтом и его сотрудниками (В. А. Энгельгардт, M. Н. Любимова, Т. В. Венкстерн, М. Я. Тимофеева, Ю. В. Бабская, ДАН СССР, XXXV, 397, 1952). В результате проведенной работы было выяснено, что при нагревании препаратов миозина в течение 5 мин. при 53° полностью исчезает аденозинтрифосфатазная активность препаратов, но сохраняется 60—90% начальной дезаминазной активности. Отделенная от аденозинтрифоcфатазы дезаминаза представляет собой глобулин. Авторам удалось также путем осаждения миозина нз разведенных растворов малыми концентрациями солей лантана получить препараты, сохраняющие аденозинтрифосфатазную активность, но почти лишенные дезаминазной активности. Большое значение имеют данные авторов о том, что способностью соединяться с актином обладает лишь белок, имеющий аденозинтрифосфатазную активность. Белок же, обладающий дезаминазной активностью, совершенно лишен этой способности. Полученные авторами данные, таким образом, вновь подтверждают, что аденозинтрифосфатазная активность неотделима от той фракции миозиновых препаратов, которая играет основную роль в образовании сократимого комплекса белков мышечной ткани. — Прим. ред.
Из изложенного выше видно, что как структура сократимых элементов поперечнополосатой мышцы, так и механизм ее сокращения еще очень неясны. Сокращение мышцы начинается, как известно, через несколько тысячных долей секунды после электрического или нервного раздражения; поэтому очевидно, что деформацию молекул миозина может вызывать только крайне быстро протекающая химическая реакция. Вероятнее всего — это ионная реакция [128], так как только ионные реакции протекают с такой большой скоростью; ферментативные же реакции для своего осуществления требуют значительно больше времени.
В настоящее время имеются лишь немногие экспериментальные данные, на основании которых можно высказать некоторые предположения относительно характера ионной реакции, лежащей в основе мышечного сокращения. Так, например, известно, что в покоящейся мышце большая часть ионов калия находится в связанной форме и неспособна диализироваться; однако сразу же после сокращения мышцы эти ионы легко переходят в диализат. Ионы калия, вероятно, отщепляются от отрицательно заряженных карбоксильных групп миозина и других мышечных белков. Второе важное наблюдение состоит в том, что при сокращении мышцы происходит небольшое уменьшение ее общего объема (0,02 мм3 на 1 г мышцы) [129]. Это уменьшение объема мышцы можно объяснить тем, что количество свободной воды в ней уменьшается в связи с гидролизом или гидратацией белков или других ионов. Наиболее вероятное допущение состоит в том, что при сокращении мышцы происходит гидратация освобождающихся ионов калия и карбоксильных групп [129]:
![]()
Возможно, что это перемещение воды и вызывает деформацию молекул миозина [130].
В процессе мышечного сокращения освобождаются не только ионы калия, но также ионы кальция [131] и фосфата [132]. Так как при этом в пептидных цепях также появляются новые положительно и отрицательно заряженные группы, то взаимная их нейтрализация тоже должна вести к укорочению молекул миозина [133, 134] (фиг. 37).
Фиг. 36. Актомиозин [82].
С другой стороны, необходимо принять во внимание, что двухвалентные ионы, например ионы кальция или фосфата, могут образовывать мостики между одноименно заряженными радикалами пептидной цепи и таким способом вызывать сокращение [135]. Такое сокращение аналогично сокращению кератиновых волокон, погруженных в медноаммиачный раствор [136]; ![]() знак минус в кружках — группы
знак минус в кружках — группы ![]() если отщепить затем ионы меди путем подкисления раствора, то сократившиеся кератиновые волокна вновь растягиваются [136].
если отщепить затем ионы меди путем подкисления раствора, то сократившиеся кератиновые волокна вновь растягиваются [136].
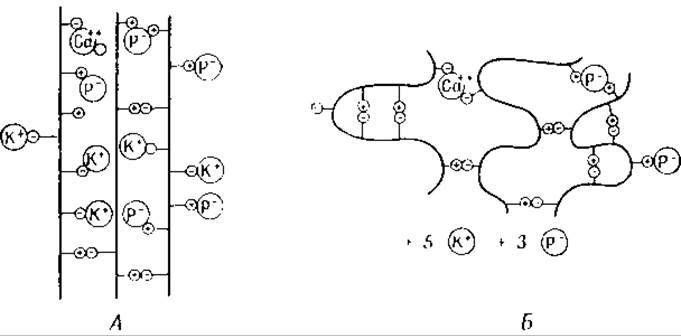
Фиг. 37. Молекулы миозина.
А — в покоящейся мышце: Б — в сокращенной мышце. К+— ионы калия; Р- — ионы фосфата; Са++ —ионы кальция. Знак плюс в кружках — группы
Хотя мы еще не в состоянии достаточно удовлетворительно объяснить механизм действия различных ионов на сократимые белки мышечного волокна, тем не менее нет никакого сомнения в том, что пространственная конфигурация мышечного волокна тесно связана с наличием на его поверхности электрического заряда. Это подтверждается и тем, что pH мышцы повышается при ее пассивном растяжении [137, 138].
Ни одна из гипотез, предложенных для объяснения механизма мышечного сокращения, не может удовлетворительным образом объяснить необычайно сильное сокращение некоторых мышц. Так, например, мышца голотурии Thyone уменьшается при сокращении примерно до 8—9% своей первоначальной длины [84]. Такое уменьшение вряд ли может быть следствием того скручивания волокон, которое изображено на фиг. 36 [139]. Возможно, что здесь мы имеем дело с разрывом многих поперечных ионных связей между растянутыми параллельно лежащими волокнами миозина, которые в результате этого превращаются в глобулярные частицы.
Вопросы, связанные с энергетикой мышечного сокращения, также еще далеки от своего разрешения. Более того, мы даже не можем с определенностью сказать, является ли расслабление мышцы пассивным или активным процессом, хотя последнее предположение вероятнее [140]. Если предположить, что мышца состоит из жестких палочковидных частиц, соединенных между собой «конец с концом» при помощи гибких связей и погруженных в жидкую среду, то можно вычислить модуль упругости Е по следующей формуле [141]:
Е = 9RTW/5M,
где R — газовая постоянная, Т — абсолютная температура, W — вес упругого материала в 1 мл объема и М — молекулярный вес отдельной цепи. Увеличение электрического заряда на поверхности палочковидных частиц ведет к уменьшению модуля упругости и, следовательно, к расслаблению мышцы; наоборот, уменьшение свободного заряда этих частиц должно вести к сокращению мышцы [142]. Зависимость между числом n заряженных групп и изменением модуля упругости ∆Е выражается следующим уравнением [142]:
![]()
где De — диэлектрическая постоянная (~100), N — число Авогадро, М — молекулярный вес (около 106), р — плотность, L — среднее расстояние между концевыми заряженными группами (около 104Å), n — число зарядов, е — величина электрического заряда. Если ∆Е = 105 дин/см2, то величина п, вычисленная по вышеприведенной формуле, равна примерно 100 [142].
Во время сокращения мышцы происходит превращение химической энергии в механическую. Можно вычислить термодинамические характеристики этой реакции, если предположить, что «растянутый миозин» и «сокращенный миозин» являются модификациями одного и того же белка, и если исследовать взаимные превращения обеих модификаций при различных температурах (см. стр. 158). Проведенные измерения показали, что изменения в свободной энергии (∆F) составляют 7 000—8 500 кал/моль, а тепловой эффект равен 53 500—56 000 кал/моль [143].