Химия и биология белков - Ф. Гауровитц 1953
Сложные белки
Нуклеопротеиды
Хотя нуклеопротеиды являются одной из наиболее важных групп сложных белков, они пока еще сравнительно мало изучены. Большое биологическое значение нуклеопротеидов подтверждается тем, что они присутствуют во всех клетках организма, а также входят в состав вирусов и бактерий [246]. Нуклеопротеиды состоят из белка и простетической группы — нуклеиновой кислоты. Поскольку многие авторы рассматривают нуклеиновые кислоты как шаблон или матрицу, служащую для синтеза белка in vivo, необходимо подробнее ознакомиться со строением этих соединений.
Полный гидролиз нуклеиновых кислот приводит к образованию эквивалентных количеств фосфорной кислоты, пентозы и пуриновых или пиримидиновых оснований. При гидролизе нуклеиновых кислот ферментами желудочного или поджелудочного сока образуются мононуклеотиды. Мононуклеотиды содержат 1 молекулу фосфорной кислоты, 1 молекулу пентозы и 1 молекулу пуринового или пиримидинового основания [247, 248]. Расщепление мононуклеотидов может быть вызвано действием ферментов кишечного сока или печени [249—251]. Чтобы определить более точно продукты полного расщепления нуклеиновых кислот, можно сказать, что при таком гидролизе образуются: 1) фосфорная кислота; 2) рибоза или дезоксирибоза; 3) пуриновые основания — аденин и гуанин, и пиримидиновые основания — тимин, цитозин и урацил [252, 253].
Общую структуру мононуклеотидов можно изобразить следующим образом: основание — пентоза — фосфорная кислота. Пентозиды, входящие в состав мононуклеотидов, получили название нуклеозидов. Углевод нуклеозидов соединен с азотом пуриновых оснований в положении 9 или с азотом пиримидиновых оснований в положении 3. Фосфорная кислота связана эфирной связью с третьей или пятой гидроксильной группой пентозы.
Строение типичного нуклеозида и мононуклеотида показано следующими формулами:
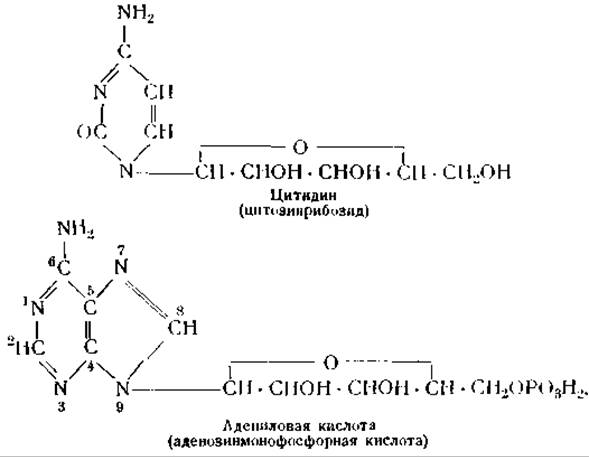
В нуклеиновых кислотах мононуклеотиды соединены друг с другом остатками фосфорной кислоты. При этом образуются цепи следующего строения:
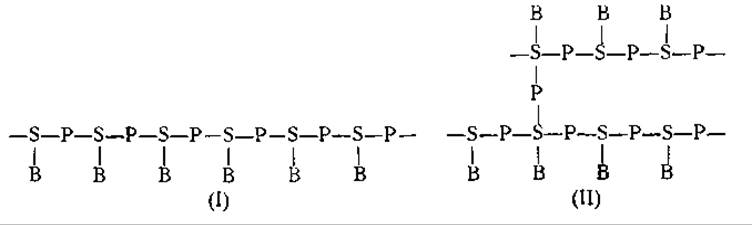
В приведенных выше формулах S обозначает углевод (рибозу или дезоксирибозу), Р — фосфорную кислоту и В — пуриновое или пиримидиновое основание [250].
До сих пор еще не разрешены многие вопросы, касающиеся строения цепей нуклеотидов в молекуле нуклеиновых кислот. Неизвестно, являются ли эти цепи прямыми (формула I) или разветвленными (формула II), содержат ли они более мелкие субъединицы, такие, как тетра- или пентануклеотиды, и, наконец, правильно ли чередуются молекулы пуриновых и пиримидиновых оснований в цепях нуклеотидов или же их расположение случайно [254, 255].
Препараты нуклеиновых кислот первоначально получали путем экстрагирования щелочами с последующим осаждением кислотами. Под воздействием кислот и щелочей макромолекулы нуклеиновых кислот, однако, меняются и их растворы при pH <5,6 и > 10,9 [256] теряют характерную для них высокую вязкость, что обусловлено, вероятно, дезагрегацией макромолекул. Дезагрегация обладающих высокой вязкостью полимерных нуклеиновых кислот вызывается также действием двух ферментов: рибонуклеазы и дезоксирибонуклеазы [257, 258]. Оба фермента были выделены Кунитцом из поджелудочной железы в кристаллической форме (см. гл. XII).
Препараты природных макромолекулярных нуклеиновых кислот получают обычно из нуклеопротеидов, экстрагируемых из тканей солевыми растворами или водой. Если эти нуклеопротеиды осторожно диализовать или подвергнуть встряхиванию с хлороформом [259], то они расщепляются на белок и полимерную нуклеиновую кислоту. Белок может быть удален путем его денатурации или при помощи высаливания хлористым натрием [260]. Молекулярный вес макромолекулы нативной тимонуклеиновой кислоты, по данным различных исследователей [261—264], варьирует от 820 000 до 3 700 000. Длина нитевидной молекулы этой кислоты равна приблизительно 5 000 Å, а ее поперечный диаметр составляет 18—20 А [262—264].
В зависимости от строения пентозы, входящей в состав нуклеиновых кислот, эти последние делятся на два типа: рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК). Пока нет никаких данных о существовании нуклеиновых кислот, которые содержали бы одновременно два типа пентозы [256]. Рибонуклеиновая кислота идентична «дрожжевой нуклеиновой кислоте» старых авторов, а дезоксирибонуклеиновая кислота — «тимонуклеиновой кислоте», выделенной из зобной железы. Старые обозначения оказались непригодными, так как выяснилось, что дрожжи содержат также и небольшие количества дезоксирибонуклеиновой кислоты. Отношение РНК/ДНК в дрожжах колеблется от 30 до 50 [265]. Ядра животных и растительных клеток содержат главным образом ДНК, цитоплазма же этих клеток — РНК [266, 267] (см. гл. XVII).
РНК расщепляется под действием 1 н. растворов едкого натра, ДНК же является более устойчивой и выдерживает такую обработку. Этим различием пользуются для количественного определения обеих нуклеиновых кислот в тех случаях, когда они присутствуют в растворе совместно [268]. После разрушения РНК едким натром ДНК может быть осаждена прибавлением кислых растворов белков [268].
В тканях оба типа нуклеиновых кислот могут быть дифференцированы при помощи реакции Фейльгена [269]. Срезы тканей или взвесь клеток обрабатывают 1 н. раствором соляной кислоты, а затем так называемым альдегидным реактивом — сернокислым фуксином. При обработке 1 н. раствором соляной кислоты только дезоксирибоза образует альдегид, вероятнее всего, w-оксилевулиновый альдегид (СН2ОН ∙ СО ∙ СН2∙ СН2∙ СНО) [270]. Этот альдегид дает с фуксиновым реактивом красную окраску. Он же обусловливает реакцию с дифениламином, предложенную Дише [271]. Положительная реакция с указанными двумя реактивами дает основание считать, что в ткани действительно находится ДНК.
Другим важным методом, применяемым для дифференцировки РНК и ДНК, служит обработка тканей растворами специфических ферментов: рибонуклеазы и дезоксирибонуклеазы. Каждый из этих ферментов расщепляет только соответствующую нуклеиновую кислоту. Если обработать срезы тканей до и после действия указанных ферментов основными красителями, то можно определить и расположение нуклеиновых кислот в клетках [272].
Пуриновые и пиримидиновые основания интенсивно поглощают ультрафиолетовые лучи, причем максимум поглощения лежит около 2 600 А, т. е. в той области, в которой белки не обнаруживают заметного поглощения. Это дает возможность использовать кварцевый микроскоп и ультрафиолетовую микрографию для обнаружения нуклеиновых кислот [273]. Комбинируя этот метод с применением специфических ферментов, можно дифференцировать оба типа нуклеиновых кислот. Если РНК ткани предварительно расщеплена действием рибонуклеазы, то наличие поглощения в ультрафиолетовой области будет указывать на присутствие ДНК. Этим же способом можно определить и место расположения ДНК в ткани.
Выше уже указывалось, что до сих пор неизвестно, являются ли цепи нуклеотидов, составляющих молекулы обоих типов нуклеиновых кислот, прямыми или разветвленными. Видовую специфичность нуклеиновых кислот легче объяснить, исходя из наличия разветвленных цепей. Однако наличие таких разветвленных цепей до сих пор никак не подтверждено экспериментально [274].
До недавнего времени предполагали, что макромолекула нуклеиновых кислот представляет собой полимер тетра- и пентануклеотидов. Эта точка зрения была основана на том, что выделенная из дрожжей нуклеиновая кислота содержит приблизительно 4 моля фосфорной кислоты на каждый моль аденина, гуанина, цитозина и урацила. В РНК, выделенной из поджелудочной железы, на каждый моль указанных оснований приходится приблизительно 5 молей фосфорной кислоты [275].
Количественные определения по методу распределительной хроматографии дали, однако, иные цифры, которые сведены в табл. 15 [254, 276].
Таблица 15 Состав нуклеиновых кислот
|
Нуклеиновые кислоты |
Пуриновые и пиримидиновые 1 моль фосфорной |
основания, моли на кислоты |
|||
|
аденин |
гуанин |
цитозин |
урацил |
тимин |
|
|
Из дрожжей |
0,260 |
0,255 |
0,245 |
0,0825 |
— |
|
Из поджелудочной железы |
0,166 |
0,402 |
0,205 |
0,046 |
— |
|
Из зобной железы |
0,260 |
0,205 |
0,172 |
— |
0,242 |
|
Из печени свиньи |
0,310 |
0,17—0,18 |
0,200 |
0,13 |
— |
Как видно из цифр таблицы, полученные данные не согласуются с предположением о том, что нуклеиновые кислоты являются полимерами тетра- или пентануклеотидов. Лишь некоторые из этих цифр близки к соответствующим величинам (0,250 — для тетрануклеотида и 0,200—-для пентануклеотида), большинство же цифр отклоняется от них весьма значительно. В связи с этим было выдвинуто предположение о том, что макромолекулярные нуклеиновые кислоты представляют собой «статистические тетрануклеотиды», в которых пуриновые и пиримидиновые основания расположены более или менее случайно [256]. При ферментативном гидролизе было найдено, что пиримидиновые основания отщепляются гораздо быстрее, чем пуриновые. Это дало повод заключить, что пуриновые основания находятся главным образом в центре молекулы нуклеиновых кислот [277—279]. Было также установлено, что аденин и цитозин, входящие в состав нуклеиновых кислот, способны подвергаться дезаминированию и, следовательно, содержат свободные аминогруппы [280]. Эти группы могут также реагировать с ипритом, образуя тиазановые кольца [281]:
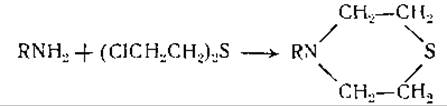
Современное состояние наших знаний не позволяет нам окончательно решить вопрос о том, обладают ли нуклеиновые кислоты видовой специфичностью. Между тем, от разрешения этого вопроса зависит и оценка биологической роли нуклеиновых кислот. Если бы оказалось, что каждый вид животных и каждый орган имеют свои специфические нуклеиновые кислоты, то можно было бы считать, что именно нуклеиновые кислоты играют решающую роль в передаче наследственных свойств. При отсутствии видовой специфичности значение нуклеиновых кислот в указанном отношении следовало бы считать второстепенным.
В связи с высоким содержанием фосфорной кислоты нуклеиновые кислоты имеют ясно выраженный кислый характер. Подобно многим другим макромолекулярным анионам они реагируют с белками, образуя солеобразные соединения, нерастворимые в зоне pH между изоэлектрическими точками белков и нуклеиновых кислот. Так, например, яичный альбумин и другие белки осаждаются нуклеиновыми кислотами при слегка кислой реакции раствора [282, 283]. Не приходится сомневаться в том, что белки соединяются с нуклеиновыми кислотами при помощи электровалентных связей. Подобно другим соединениям того же типа нуклеопротеиды растворяются в концентрированных растворах нейтральных солей [283].
Одна из главных трудностей, с которыми сталкивается химия нуклеопротеидов, состоит в том, что мы до сих пор не в состоянии ответить на вопрос, предсуществуют ли нуклеопротеиды в клетках тканей в виде солеобразных соединений нуклеиновых кислот с белками или в виде соединений, образованных какими- либо иными связями, или же они образуются только в процессе выделения, когда создаются благоприятные условия для соединения белков с нуклеиновыми кислотами при помощи солевых связей [244]. Большинство нуклеопротеидов содержит в качестве белкового компонента протамины или гистоны. Оба типа этих белков характеризуются своими резко выраженными щелочными свойствами (см. гл. VIII, стр. 197), в связи с чем они могут весьма легко образовывать солеобразные связи с нуклеиновыми кислотами. Нуклеопротамины и нуклеогистоны отличаются от других белков тем, что первые не содержат тирозина, а вторые — триптофана [284]. Повидимому, клетки содержат только нуклеопротамины или только нуклеогистоны, но не смеси обоих типов [284].
Таблица 16 Содержание триптофана и тирозина в белках, гистонах и протаминах
|
Соединение |
Триптофан |
Тирозин |
|
Белки |
+ |
+ |
|
Гистоны |
0 |
+ |
|
Протамины |
0 |
0 |
Нуклеопротамины были получены из спермы рыб, нуклеогистоны — из зобной железы и других тканей млекопитающих. Содержание нуклеиновых кислот в этих нуклеопротеидах колеблется от 31 до 66% [245]. Нуклеопротеиды, выделенные из растений или из бактерий, не содержат ни протаминов, ни гистонов; в их состав входят только истинные белки [285]. Такие же истинные нуклеопротеиды были найдены в тканях животных (см. гл. XVII).
При экстракции клеток 1-процентным раствором хлористого натрия в экстракт переходят только белки, нуклеопротеиды же не растворяются. Нуклеопротеиды, содержащие ДНК, могут быть извлечены путем повторной экстракции 6—11-процентными растворами хлористого натрия. Из этих растворов указанные нуклеопротеиды выпадают при разведении водой [286]. Растворы нуклеопротеидов очень вязки и обнаруживают сильное двойное лучепреломление в потоке. На этом основании высказывается мнение, что молекулы нуклеопротеидов имеют нитевидную форму. Отношение их осей варьирует от 40 : 1 до 60: 1 [287].
Нуклеопротеид, содержащий ДНК и гистон, был получен при экстракции зобной железы раствором хлористого натрия. Он входит в значительном количестве в состав эвхроматина ядер клеток этой железы [287], тогда как ядерный гетерохроматин содержит нуклеопротеид, в состав которого входит РНК.
Вопрос о том, содержит ли хроматин нуклеинат гистона или же какое-либо другое специфическое соединение гистона с нуклеиновой кислотой, еще окончательно не разрешен. При экстракции зобной железы водой и последующем центрифугировании экстракта с большой скоростью из железы был получен нуклеопротеид, нерастворимый в изотонических солевых растворах [288]. Этот нуклеопротеид получил название генопротеина Т. Предполагают, что как растворимый в солевых растворах нуклеопротеид, так и нерастворимый предобразованы в клетках железы.
Выше уже указывалось, что наибольшим затруднением при разрешении ряда вопросов, касающихся химии нуклеопротеидов, является то, что мы не можем отличить предобразованные в клетках нуклеопротеиды от нуклеопротеидов, образующихся в процессе выделения. О возможности образования подобных «синтетических» нуклеинатов белков свидетельствует тот факт, что тепловое свертывание белков может быть предотвращено прибавлением к раствору белка небольших количеств нуклеиновых кислот[289]. Об этом же говорит и то, что двойное лучепреломление нуклеиновых кислот исчезает при добавлении к их раствору белков [290]. До сих пор еще не установлено, участвуют ли в образовании нуклеинатов белков только электровалентные связи. Поскольку белки могут соединяться с недиссoциированными на ионы полярными соединениями, например с сахарами (см. стр. 232), нет оснований отрицать возможность участия в образовании нуклеина белков наряду с электровалентными также и дипольных связей. Это же относится и к «природным» нуклеопротсидам. Соединение нуклеиновых кислот с белками в этих нуклеопротeидах также может осуществляться как за счет электровалентных связей, так и за счет дипольных связей или связей между диполями и ионами [291].
Некоторую дифференциацию между природными нуклеопротеидами и артефактами, возникающими в процессе выделения, можно провести при помощи солей кальция. Нативные нуклеопротеиды, извлеченные из стрептококков, не осаждаются солями кальция. Если же эти нуклеопротеиды предварительно подвергнуть действию кислот, то добавление солей кальция вызывает их осаждение [292]. Эти данные истолковываются таким образом, что либо фосфорная кислота, входящая в состав нативных нуклеопротеидов, недоступна для действия иона кальция, либо под действием солей кальция образуются растворимые его соединения. Нуклеопротеиды, выделенные из печени, выпадают в осадок при прибавлении 0,03—0,06-процентных растворов хлористого кальция. Остается, однако, неизвестным, свидетельствует ли образование осадка в этом случае об образовании нерастворимых соединений кальция или же мы имеем здесь дело с коагуляцией гранул нуклеопротеида под влиянием ионов кальция [293].
Как указывалось выше, многие даже кристаллические белки оказались не однородными соединениями, а смесями различных белков. Не вызывает поэтому удивления и то, что нуклеопротеиды также во многих случаях оказались смесями. Молекулярный вес отдельных компонентов этих смесей в клетках печени варьирует от 1 600 000 до 2 300 000 [287]. Рентгеноструктурный анализ нуклеопротеидов указывает на наличие коротких периодов в 3,3 Å [294], т. е. таких же периодов, какие были обнаружены в пептидах.