Химия и биология белков - Ф. Гауровитц 1953
Белки с ферментативными свойствами
Специфичность ферментов
При рассмотрении вопроса о природе ферментов и их компонентов нужно всегда помнить, что наличие ферментов обнаруживается только по их действию на соответствующий субстрат. Чтобы определить специфичность фермента, необходимо исследовать его действие на различные субстраты, отличающиеся друг от друга лишь некоторыми особенностями строения молекулы. Этот метод исследования специфичности ферментов был в особенности развит Бергманом и его сотрудниками, работы которых имели исключительное значение для выяснения специфичности действия протеолитических ферментов. До появления этих работ не было известно, какие именно пептидные связи расщепляются пепсином, трипсином и другими протеолитическими ферментами. Бергман и его сотрудники [21] по разработанному ими методу синтезировали большое число различных пептидов и использовали эти пептиды в качестве субстратов для протеолитических ферментов. В результате этих исследований было установлено, что трипсин расщепляет преимущественно пептиды, содержащие основные аминокислоты — аргинин или лизин, тогда как пепсин действует главным образом на пептиды, содержащие ароматическую аминокислоту тирозин [22]. Эти данные позволили заключить, что щелочные боковые цепи аргинина или лизина специфически реагируют с молекулярными группами, расположенными на поверхности трипсина, тогда как структура ароматического кольца тирозина соответствует строению поверхности пепсина.
Из того факта, что ферменты гидролизуют только природные l-пептиды, следует, что для образования соединения фермента с субстратом большое значение имеет стереохимическая конфигурация субстрата. Для объяснения стереохимической специфичности ферментов необходимо допустить, что соединение фермента с субстратом происходит за счет трех или более различных атомных или молекулярных группировок [23]. Такое соединение может происходить, очевидно, только в том случае, если поверхность фермента очень тесно сближается с поверхностью субстрата, что, повидимому, возможно только при наличии между обеими этими поверхностями геометрического соответствия.
Прежде предполагали, что протеолитические ферменты способны гидролизовать только пептидные связи —CONH—. Недавно, однако, Нейрат, Шверт и их сотрудники показали, что протеолитические ферменты могут гидролизовать и эфирные связи —СО—О—.
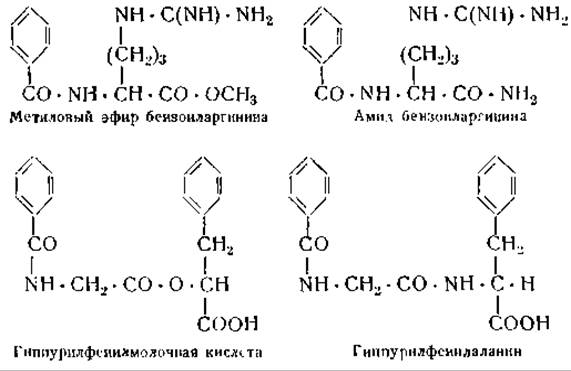
Так, например, трипсин расщепляет быстрее метиловый эфир бензоиларгинина, чем амид бензоиларгинина [24], а карбоксипептидаза расщепляет с одинаковой скоростью как гиппурилфенилмолочную кислоту, так и пептид гиппурилфенилаланин [25].
Эти опыты сильно поколебали основы классификации ферментов. Поскольку мы не можем классифицировать ферменты иначе, как по их действию на определенные субстраты, мы подразделяем их в зависимости от субстратов на протеазы, эстеразы, карбогидразы и т. д. Если, однако, трипсин и карбоксипептидаза способны расщеплять эфирные связи и если это расщепление протекает с большей скоростью, чем расщепление соответствующих пептидов, то следует отвергнуть представление о том, что специфичность ферментов характеризуется только типом расщепляемых связей.
Точно так же следует отказаться от разделения протеолитических ферментов из эндо- и экзопептидазы. До последнего времени предполагалось, что экзопептидазы действуют только на пептиды, имеющие, свободную аминную или карбоксильную группу, в связи с чем они подразделялись еще на аминопептидазы и карбоксипептидазы. Недавно, однако, было показано, что лейцинаминопептидаза способна гидролизовать глициллейцинамид, хотя остаток лейцина в этом субстрате не имеет свободной аминогруппы [26].
Из рассмотрения формул субстратов, на которые действуют трипсин и карбоксипептидаза (см. выше), очевидно, что действие этих ферментов зависит главным образом от стереохимической конфигурации молекулярных групп субстрата, от их формы и от их взаимного расположения. Химическая природа расщепляемых связей имеет, повидимому, второстепенное значение. Эта точка зрения хорошо согласуется с утверждением, что соединение фермента с субстратом происходит посредством связей, возникающих между их поверхностями, форма которых соответствует друг другу.