Химия и биология белков - Ф. Гауровитц 1953
Белки с ферментативными свойствами
Флавопротеины и пиридиннуклеотиды
Первый желтый фермент, открытый в дрожжах Варбургом и Христианом [139], был получен Теореллом [140] в кристаллическом виде. Из дрожжей этот фермент извлекается водой и осаждается из водного экстракта ацетоном или метанолом. При диализе против разбавленной соляной кислоты или при действии высоких концентраций метанола от фермента отщепляется активная группа, имеющая желтую окраску. Соляная кислота денатурирует белковый компонент фермента, на что указывает увеличение количества свободных сульфгидрильных групп; после удаления соляной кислоты диализом белок (апофермент) ренатурируется и вновь приобретает способность соединяться с желтой активной группой [140]. Прежде предполагали, что этой группой является рибофлавинфосфат.
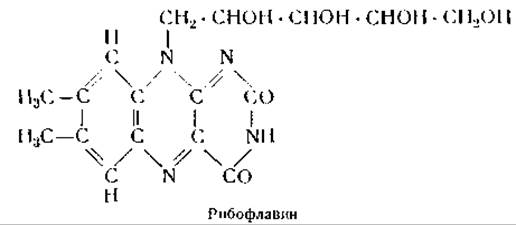
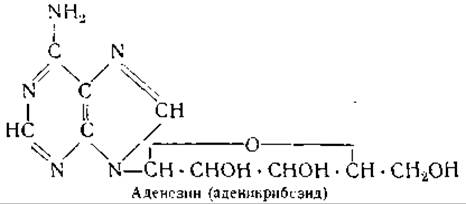
Позднее, однако, было найдено, что простетической группой флавопротеинов является флавинадениндинуклеотид, строение которого схематически можно представить формулой Фл—Ф—Ф—Р—Ад, где Фл — рибофлавин, Ф — фосфорная кислота, Р — рибоза, Ад — аденин [139]. Несмотря на то, что флавопротеины являются довольно устойчивыми ферментами, их бесцветные апоферменты в свободном виде крайне лабильны и приобретают устойчивость только при соединении с простетической группой [141]. Молекулярный вес желтого фермента равен примерно 80 000 [142], и каждая молекула фермента содержит 1 молекулу флавинадениндинуклеотида. Весьма вероятно, что динуклеотид соединяется с основными группами белкового компонента посредством фосфорной кислоты.
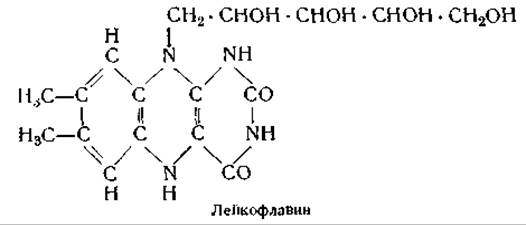
Каталитическое действие флавопротеинов основано на способности простетических групп этих ферментов принимать электроны и переносить их на другие вещества. Восстановленная форма простетической группы, получившая название лейкофлавина, является бесцветным соединением, однако, отдавая два электрона (т. е. окисляясь), она вновь приобретает желтую окраску.
Большое влияние апоферменти на каталитическую активность простетической группы подтверждается значительным сдвигом окислителыю-восстановительного потенциала флавина при соединении его с белком; в то время как окислительно-восстановительный потенциал системы, состоящей из эквивалентных концентраций окисленного и восстановленного флавина, равен —0,060 в при pH 7, окислительно-восстановительный потенциал системы, состоящей из эквивалентных концентраций окисленного и восстановленного флавопротеина, равен приблизительно —0,185 в [143].
Большое значение белкового компонента флавопротеинов проявляется также в ясно выраженной специфичности этих ферментов. В настоящее время известно, по крайней мере, 10 различных флавопротеинов, которые содержат в качестве простетической группы либо рибофлавинфосфат, либо флавинадениндинуклеотид, но отличаются друг от друга белковыми компонентами. Наиболее важными представителями флавопротеинов являются оксидаза d-аминокислот [144], оксидаза l-аминокислот, глициноксидаза [145], глюкозооксидаза из плесневых грибов [146], ксантиноксидаза [147], гидрогеназа фумаровой кислоты [148], цитохромредуктаза [149], гистаминаза [150] и диафораза [151]. Последний фермент катализирует окисление восстановленных пиридиннуклеотидов (см. дальше) в присутствии метиленового синего. Как уже указывалось, различные флавиновые ферменты отличаются друг от друга только по строению своего апофермента, однако до сих пор не установлено, в чем конкретно заключаются их различия. Неизвестно также, каким путем апофермент влияет на простетическую группу, обусловливая специфический катализ окисления только определенных типов соединений.
В этом отношении с флавопротеинами сходны ферменты, имеющие в качестве простетической группы дифосфопиридинуклеотид (ДФН) или трифосфопиридиннуклеотид (ТФН) [152]. Имеется, однако, одно существенное различие между этой группой ферментов и флавопротеинами. Флавопротеины относятся к классу сложных белков, небелковые компоненты которых связаны более или менее прочно со своими специфическими белками и отщепляются только под воздействием кислоты или метилового спирта, тогда как апоферменты ДФН и ТФН менее прочно связаны со своими ферментами [153], так что даже в нейтральных водных растворах большая часть нуклеотида находится в свободном состоянии. Химическая структура ДФН и ТФН может быть представлена в следующем виде: Н—Р—Ф—Ф—Р—Ад и Н—Р—Ф—Ф—Ф—Р—Ад, где Н — амид никотиновой кислоты, Р — рибоза, Ф — фосфорная кислота, Ад — аденин. Дифосфопиридиннуклеотид, называемый иначе козимазой или кодегидразой I, экстрагируется из дрожжей соляной кислотой [154]; после осаждения белков уксуснокислым свинцом и последующего удаления из фильтрата свинца нуклеотид адсорбируется на норите и элюируется амиловым спиртом и водoй [155]. Трифосфопиридиннуклеотид был извлечен из эритроцитов ацетоном и осажден из ацетонового экстракта уксуснокислой ртутью [156]. Эти два кофермента, вступая во временное и непрочное соединение со специфическими белками, образуют различные ферменты [154].
Наиболее важными субстратами для действия ферментов, содержащих ДФН и ТФН, являются молочная кислота, триозофосфат, глюкоза, спирт, глюкозо-6-фосфат, глицерофосфат, яблочная кислота, изолимонная кислота, фосфоглюконовая кислота, глутаминовая кислота и муравьиная кислота. Как и в случае флавопротеинов, апоферменты различных ферментов, содержащих ДФН и ТФН, строго специфичны; некоторые апоферменты были получены в кристаллическом виде.
Алкоголmдегидраза была получена в кристаллическом виде из дрожжевого экстракта путем осаждения ацетоном или этиловым спиртом [157]. Лактикодегидраза была выделена из сердечной мышцы, причем для ее очистки была применена адсорбция на трехзамещенном фосфате кальция с последующей элюцией при pH 7,2 [158]. Кристаллический препарат этого фермента был получен также путем осаждения ртутными солями с последующим удалением ртути путем диализа против раствора цианида [159]. Дегидраза 1,3-дифосфоглицероальдегида, катализирующая окисление 1,3-дифосфоглицероальдегида в фосфоглицериновую кислоту, была выделена в кристаллическом виде из дрожжевого сока путем осаждения нуклеиновой кислотой; последняя удалялась при осаждении протамином стурином, а затем при осторожном добавлении к раствору белка сернокислого аммония были получены кристаллы фермента [160]. Кристаллическая дегидраза 3-фосфоглицероальдегида была получена из мышцы путем экстракции 0,03 н. раствором едкого кали с последующим осаждением сернокислым аммонием [161]. Этот фермент был обнаружен в миогеновой фракции мышц (см. гл. VIII, стр. 186), причем количество его составляет приблизительно 10% растворимых мышечных белков [162]. Апоферменты дегидразы фосфоглицероальдегида, выделенные из дрожжей и из мышц, оказались различными [163]. Белковые компоненты всей этой группы ферментов обладают, вероятно, не только специфичностью в отношении отдельных субстратов, но и видовой специфичностью. К пиридиновым ферментам принадлежат также цитохромредуктазы, восстанавливающие трехвалентное железо в цитохроме с в двухвалентное. Было найдено, что цитохромредуктаза из дрожжей имеет в качестве простетической группы дифосфопиридиннуклеотид, тогда как простетической группой цитохромредуктазы печени является трифосфопиридиннуклеотид [164].