ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
19. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ И ФОТОФОСФОРИЛИРОВАНИЕ
19.4. Роль митохондрий в термогенезе, синтезе стероидов и апоптозе
Основная функция митохондрий — синтез АТР. Однако митохондрии также принимают участие в процессах, которые в некоторых тканях и при некоторых обстоятельствах становятся решающими. В жировой ткани митохондрии создают тепло, чтобы защитить жизненно важные органы от переохлаждения, в надпочечниках и половых железах митохондрии задействованы в синтезе стероидных гормонов и практически во всех тканях они участвуют в процессе апоптоза (программируемой клеточной гибели).
Разобщение дыхания и фосфорилирования в митохондриях бурого жира позволяет генерировать тепло
Мы упоминали выше, что при адекватном поступлении АТР в клетку скорость дыхания снижается. Из этого общего правила есть одно интересное исключение. У большинства новорожденных млекопитающих, в том числе у новорожденных детей, есть особая жировая ткань — бурый жир (с. 588). Ее назначение в том, чтобы в процессе окисления жиров предотвращать синтез АТР и вырабатывать тепло, благодаря которому температура тела новорожденных поддерживается на должном уровне. Эта особая жировая ткань действительно окрашена в бурый цвет, потому что в ней очень много митохондрий с большим содержанием цитохромов, гемовые группы которых интенсивно поглощают в видимой области спектра.
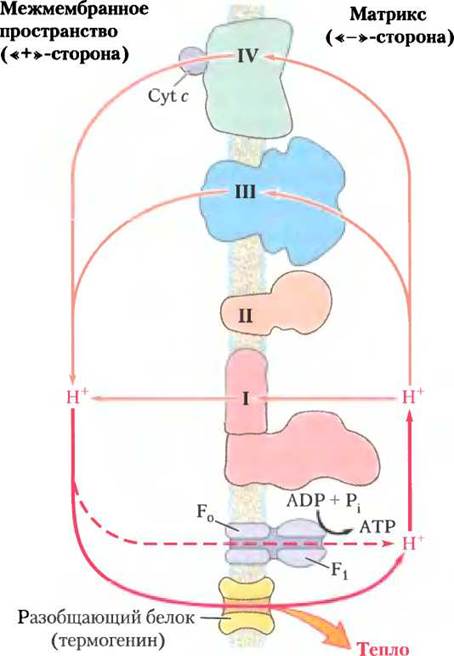
Митохондрии бурого жира во многом похожи на митохондрии других клеток млекопитающих, но содержат во внутренней мембране разобщающий белок термогенин (продукт гена UCP1). Благодаря термогенину ионы Н+, выведенные из митохондрий за счет энергии переноса электронов, возвращаются в матрикс минуя ферментативный комплекс F0F1 (рис. 19-34). В результате свободная энергия переноса электронов используется не для синтеза АТР, а для выработки тепла, которое идет на поддержание нужной температуры тела (см. рис. 23-17). У некоторых животных, впадающих в зимнюю спячку, разобщение дыхания и фосфорилирования в митохондриях бурого жира позволяет генерировать тепло для поддержания температуры тела во время спячки (см. доп. 17-1). Мы вернемся к роли термогенина при обсуждении регуляции массы тела в гл. 23.
Рис. 19-34. Образование теплоты при разобщении дыхания и фосфорилирования в митохондриях. Разобщающий белок (термогенин), локализованный в мембране митохондрий бурого жира, имеет специальные поры для ионов Н+. Ионы Н+, выведенные из митохондрий в результате переноса электронов, возвращаются в митохондриальный матрикс через эти поры, минуя АТР- синтазу, вследствие чего энергия, протонного градиента рассеивается в виде теплоты, а не используется для синтеза АТР.
Митохондриальные ферменты системы Р-450 катализируют гидроксилирование стероидов
В митохондриях происходят реакции биосинтеза, приводящие к образованию стероидных гормонов, включая половые гормоны, глюкокортикоиды, минералокортикоиды и витамин D. Эти вещества синтезируются из холестерина или родственных веществ в серии реакций гидроксилирования, катализируемых ферментами из семейства цитохрома Р-450. в каждом из которых присутствует гемовая группа (способность гема поглощать свет на длине волны 450 нм дала название всему семейству ферментов). В реакциях гидроксилирования один атом молекулярного кислорода включается в субстрат, а второй восстанавливается до Н2O
R-H + O2 + NADPH —> R-OH + Н2O + NADP+
Семейство Р-450 объединяет несколько десятков ферментов, и все они сосредоточены на внутренней митохондриальной мембране, а их каталитические центры обращены в сторону матрикса. Стероидогенные клетки (клетки, синтезирующие стероиды) содержат митохондрии, специализирующиеся на синтезе стероидов; такие митохондрии обычно крупнее митохондрий клеток других тканей и имеют более развитую и извитую поверхность внутренней мембраны (рис. 19-35).
Рис. 19-35. Митохондрии надпочечников, специализирующиеся на синтезе стероидов. Как видно на этой электронной микрофотографии тонкого среза ткани надпочечников, здесь сосредоточено множество митохондрий с многочисленными кристами, что обеспечивает большую поверхность внутренней мембраны, на которой локализуются ферменты системы Р-450.
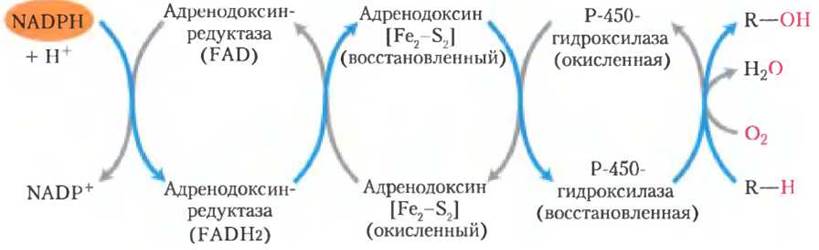
Путь электронов в митохондриальной системе Р-450 достаточно сложен; в нем участвуют флавопротеин и железосерный белок, переносящие электроны от NАDРН к гему Р-450 (рис. 19-36). Структура ферментов семейства Р-450 обеспечивает их субстратную специфичность и позволяет гемовой группе реагировать непосредственно с молекулой O2.
Рис. 19-36. Путь передачи электронов с участием системы цитохрома Р-450 в митохондриях клеток надпочечников. Два электрона передаются от NADРН к FАD-содержащему флавопротеину адренодоксинредуктазе, который пропускает по одному электрону к адренодоксину — небольшому растворимому в воде 2Fе-2S-белку. Адренодоксин передает одиночные электроны к гидроксилазе системы цитохрома Р-450, которая непосредственно взаимодействует с O2 и субстратом (R-Н), образуя продукты: Н2O и R-ОН.
Еще одно большое семейство ферментов Р-450 обнаружено в эндоплазматическом ретикулуме гепатоцитов. Эти ферменты катализируют реакции, сходные с теми, что происходят при участии митохондриальных ферментов семейства Р-450, однако круг их субстратов очень широк, в частности, разнообразные гидрофобные соединения, многие из которых — ксенобиотики (вещества, которые не встречаются в природе, а образуются только в промышленных процессах). Ферменты семейства Р-450, находящиеся в эндоплазматическом ретикулуме, характеризуются широкими и перекрывающимися между собой субстратными специфичностями. Гидроксилирование гидрофобных соединений улучшает их растворимость в воде, что способствует их выведению из организма с мочой через почки. К субстратам оксигеназ семейства Р-450 относятся многие распространенные лекарственные препараты. Реакции, катализируемые ферментами семейства Р-450, сокращают время жизни лекарственных препаратов в кровотоке и снижают их терапевтическое действие. У разных людей набор цитохромов Р-450 в эндоплазматическом ретикулуме несколько различается в связи с генетическими особенностями, а для некоторых ферментов этого семейства обнаружены также индивидуальные вариации степени их индуцирования, например, в связи с употреблением алкоголя. Поэтому при назначениях лекарственных препаратов и выборе дозы очень важно учитывать генетические особенности и историю болезни пациента; однако на практике такой индивидуальный подход не реализуется из экономических соображений, но, возможно, он станет возможен в будущем. ■
Митохондрии играют важную роль в инициировании апоптоза
Апоптоз, или программируемая гибель клетки, заключается в гибели отдельных клеток, когда это необходимо организму (например, в процессе нормального эмбрионального развития); при этом организм сохраняет компоненты клетки, такие как аминокислоты, нуклеотиды и т. д. Апоптоз может быть вызван внешним сигналом, действующим на рецепторы плазматической мембраны, а также внутренними событиями, такими как повреждение ДНК, вирусная инфекция, окислительное повреждение под действием АФК или другой стресс, например, тепловой шок.
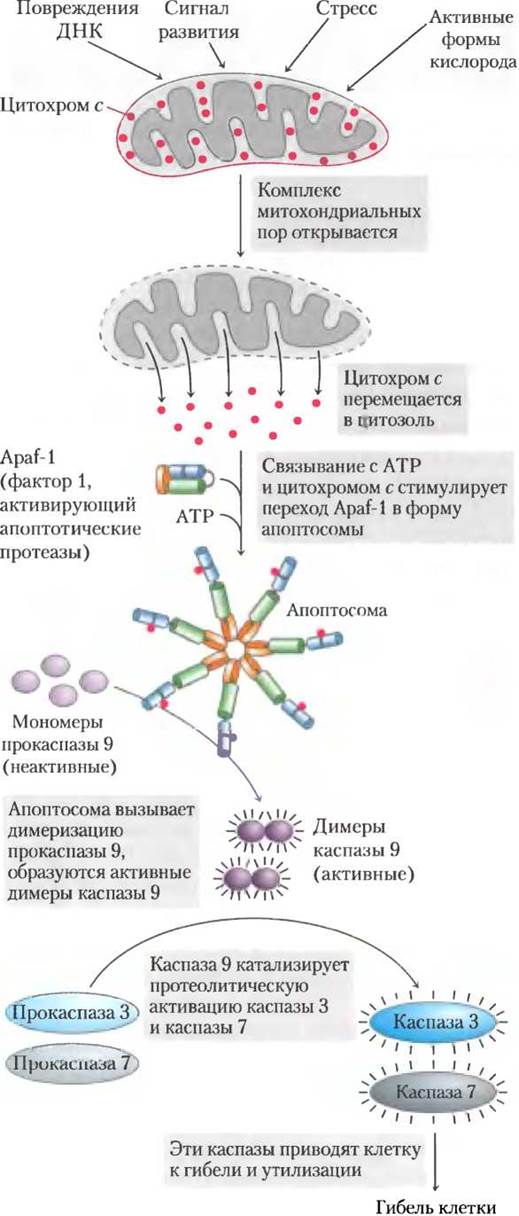
Митохондрии играют очень важную роль в запуске апоптоза. Когда в результате стресса поступает сигнал к уничтожению клетки, одно из первых изменений — повышение проницаемости внешней мембраны митохондрий, что позволяет цитохрому с проникнуть из межмембранного пространства в цитозоль (рис. 19-37). Повышение проницаемости мембраны происходит благодаря открыванию так называемых гигантских пор, образованных субъединицами белка во внешней мембране митохондрий. На открывание и закрывание этих пор влияют некоторые белки, стимулирующие или подавляющие апоптоз. При переходе в цитозоль цитохром с взаимодействует с мономерами белка Apaf-1 (apoptosis protease activating factor-1), что приводит к образованию апоптосомы, состоящей из семи молекул Apaf-1 и семи молекул цитохрома с. В апоптозоме происходит активация протеазы прокаспазы-9 с образованием каспазы-9, принадлежащей к семейству специфичных протеаз (каспаз), участвующих в апоптозе. В активном центре всех белков этого семейства присутствует остаток цистеина, и все они расщепляют белки только у остатка аспарагина, причем со стороны С-конца аминокислотной последовательности; отсюда происходит их название — каспазы (от англ. caspase: carboxyl-terminal side of Asp residues). Активированная каспаза-9 инициирует каскад протеолитических процессов, в которых одна каспаза активирует другую, та — третью и т. д. (см. рис. 12-51). Участие цитохрома с в процессе апоптоза — пример реализации скрытых функций фермента.
Рис. 19-37. Роль цитохрома с в апоптозе. Цитохром с — небольшой растворимый митохондриальный белок, расположенный в межмембранном пространстве; его функция заключается в переносе электронов между комплексами III и IV в дыхательной цепи. Однако он выполняет в клетке еще одну, совершенно иную функцию, запуская апоптоз путем стимуляции семейства протеиназ, называемых каспазами.
Краткое содержание раздела 19.4 Роль митохондрий в термогенезе, синтезе стероидов и апоптозе
■ У новорожденных в митохондриях бурого жира перенос электронов по дыхательной цепи и синтез АТР разобщены, поэтому свободная энергия, высвобождающаяся при окислении жирных кислот, рассеивается в виде метаболического тепла.
■ При синтезе стероидных гормонов в стероидогенных тканях (надпочечниках, половых железах, печени и почках) реакции гидроксилирования осуществляются в специализированных митохондриях.
■ В процессе апоптоза разрушение белка происходит под действием протеолитического фермента каспазы 9, который активизируется цитохромом с, вышедшим из межмембранного пространства в цитозоль при получении клеткой сигнала к апоптозу.