Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Концентрация субстрата оказывает огромное влияние на скорость реакций, катализируемых ферментами
Давайте рассмотрим влияние изменения концентрации субстрата на начальную скорость ферментативной реакции при постоянной концентрации фермента к Vmax, но никогда ее не достигает. Концентрация субстрата, при которой скорость реакции составляет половину максимальной, численно равна константе Михаэлиса Ментен.
(рис. 9-4). При очень низких концентрациях субстрата скорость реакции очень мала, но постепенно возрастает по мере повышения концентрации субстрата. Если мы будем измерять начальную скорость каталитической реакции при разных. все возрастающих концентрациях субстрата, то обнаружим, что приращения скорости становятся с каждым разом все меньше и меньше. Наконец, наступает момент, когда любое увеличение концентрации субстрата вызывает лишь бесконечно малое ускорение реакции (рис. 9-4). Как бы ни увеличивалась при этом концентрация субстрата, скорость реакции может лишь приближаться к плато, но никогда его не достигнет. На этом плато, называемом максимальной скоростью реакции (Vmах), фермент «насыщен» субстратом и не может функционировать быстрее.
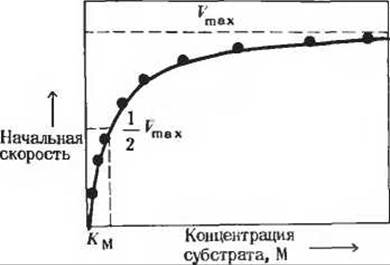
Рис. 9-4. Влияние концентрации субстрата на начальную скорость катализируемой ферментом реакции. Из такого графика можно определить величину Vmax только путем аппроксимирования. Точное определение этой величины в данном случае невозможно, так как по мере повышения концентрации субстрата начальная скорость реакции лишь приближается
Такой эффект насыщения свойствен почти всем ферментам. Это наблюдение позволило Виктору Генри сделать в 1903 г. вывод, что необходимой стадией ферментативного катализа является соединение фермента с субстратом, в результате чего образуется фермент-субстратный комплекс. Развитие этой идеи привело в дальнейшем к созданию общей теории действия ферментов; особенно большой вклад в эту теорию внесли Леонор Михаэлис и Мод Ментен. В 1913 г. они постулировали, что фермент Е сначала обратимо и относительно быстро соединяется со своим субстратом S в реакции
Е + S ⇄ ES.
Образовавшийся при этом фермент-субстратный комплекс затем распадается во второй более медленной обратимой реакции с образованием продукта реакции Р и свободного фермента Е
ES ⇄ Е + Р.
Поскольку эта вторая, более медленная реакция представляет собой стадию, лимитирующую скорость всего процесса, общая скорость катализируемой ферментом реакции должна быть пропорциональна концентрации фермент-субстратного комплекса ES. В ходе каталитической реакции в любой момент времени фермент существует в двух формах: в свободной, или несвязанной, форме и в связанном виде, т. е. в составе комплекса ES. Скорость каталитической реакции, очевидно, будет максимальной, когда фактически весь фермент перейдет в комплекс ES, а концентрация свободного фермента Е станет предельно низкой. Это условие выполняется только при очень высоких концентрациях субстрата, так как, согласно закону действующих масс, при повышении концентрации S равновесие первой реакции сдвигается вправо
Е + S ⇄ ES.
Если мы повысим концентрацию S до достаточно высокого уровня, то практически весь фермент Е перейдет в форму ES. В ходе второй реакции каталитического цикла комплекс ES непрерывно и быстро распадается на продукт Р и свободный фермент. Но если концентрация S достаточно высока, свободный фермент будет сразу же взаимодействовать с другой молекулой S. В этих условиях устанавливается некое стационарное состояние, при котором фермент полностью насыщен субстратом и реакция протекает с максимальной скоростью.