Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Цикл лимонной кислоты
Цикл лимонной кислоты включает восемь стадий
Рассмотрим теперь восемь последовательных стадий цикла лимонной кислоты, уделяя особое внимание тем химическим превращениям, в результате которых ацетильная группа ацетил-СоА перестраивается и в конечном счете распадается с образованием СО2 и атомов водорода, улавливаемых в форме восстановленных коферментов NADH и FADH2 ∙ На рис. 16-12 и 16-13 приведены сбалансированные уравнения реакций цикла и показана структура промежуточных продуктов.
а. Конденсация ацетил-СоА с оксалоацетатом приводит к образованию цитрата
Первая реакция цикла, катализируемая цитрат-синтазой, представляет собой конденсацию ацетил-СоА и оксалоацетата, в результате которой образуется цитрат (рис. 16-12). В этой реакции метальный углерод ацетильной группы ацетил-СоА связывается с карбонильной группой оксалоацетата; одновременно расщепляется тиоэфирная связь и высвобождается кофермент А:

Равновесие этой реакции в клетке по большей части сильно сдвинуто вправо, о чем свидетельствует характеризующая ее большая отрицательная величина стандартной свободной энергии гидролиза. Высвободившийся CoA-SH может теперь принять участие в окислительном декарбоксилировании новой молекулы пирувата и образовать новую молекулу ацетил-СоА, способную вступить в цикл. Полагают, что промежуточным продуктом в цитрат-синтазной реакции является цитрил-СоА. Он образуется в активном центре фермента и быстро гидролизуется, после чего свободный CoA-SH и цитрат отделяются от активного центра.
Цитрат-синтаза принадлежит к числу регуляторных ферментов: в клетках многих типов катализируемая ею реакция лимитирует общую скорость цикла лимонной кислоты.
б. Цитрат превращается в изоцитрат через цис-аконитат
Фермент аконитаза катализирует обратимое превращение цитрата в изоцитрат. В качестве промежуточного продукта (в норме не отделяющегося от активного центра фермента) образуется при этом трикарбоновая циc-аконитовая кислота (рис. 16-12). Аконитаза катализирует обратимое присоединение Н2О по двойной связи цис-аконитата (который присоединен к ферменту) двумя разными способами: в одном случае образуется цитрат, а в другом - изоцитрат:
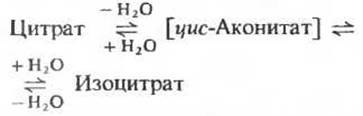
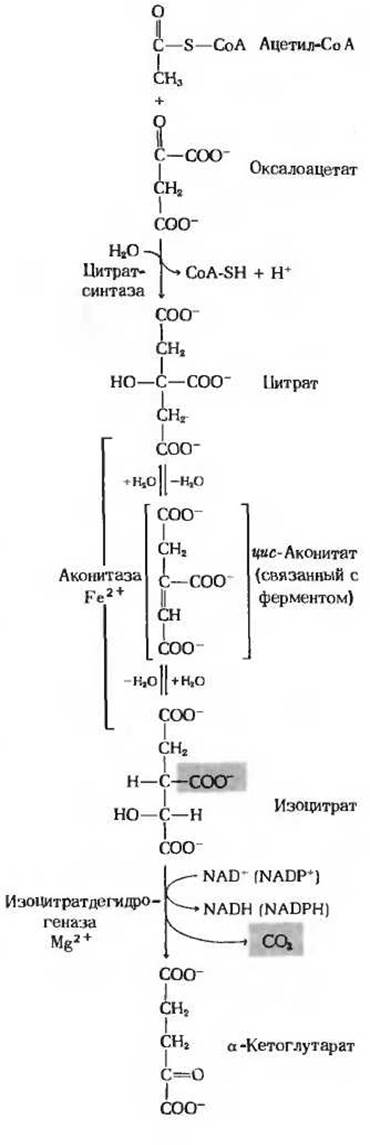
Рис. 16-12. Первые четыре реакции цикла лимонной кислоты. Приведены уравнения полного химического баланса.
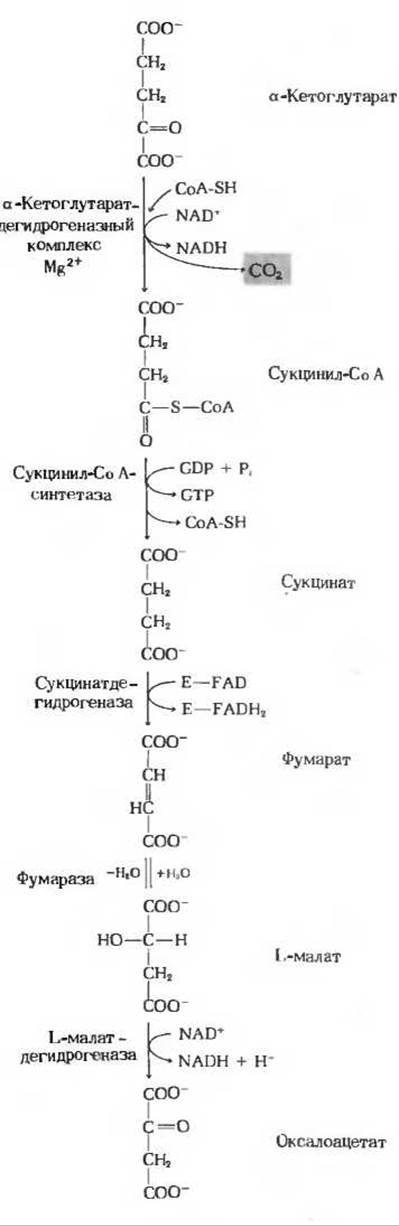
Рис. 16-13. Остальные реакции цикла лимонной кислоты (предшествующие стадии см. на рис. 16-12).
Хотя в равновесной смеси при pH 7,4 и 25 С содержание изоцитрата составляет менее 10%, в клетке эта реакция протекает слева направо, поскольку продукт реакции, изоцитрат, быстро вовлекается в последующие стадии цикла. Аконитаза - довольно сложный фермент. Он содержит железо и кислотолабильные атомы серы, сгруппированные в так называемый железо-серный центр (разд. 17.8). Точная функция этого железо-серного центра (который представляет собой, как полагают, простетическую группу фермента) пока не известна.
в. Изоцитрат дегидрируется с образованием а-кетоглутарата и СО2
На следующей стадии цикла изоцитрат дегидрируется с образованием а-кетоглутарата и СО2 (рис. 16-12) под действием изоцитратдегидрогеназы. Существует два типа изоцитратдегидрогеназы: один использует в качестве акцептора электронов NAD+, а другой-NАDР+. В остальном же суммарные реакции, катализируемые изоцитратдегидрогеназами этих двух типов, идентичны:
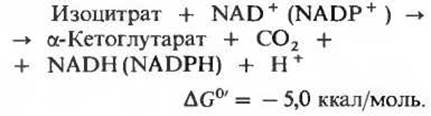
В митохондриях содержатся изоцитратдегидрогеназы обоих типов, NAD-зависимая и NADP-зависимая; первый тип встречается только в митохондриях, а второй обнаруживается как в митохондриях, так и в цитозоле. В цикле лимонной кислоты, очевидно, принимают участие оба митохондриальных фермента, но преобладает NАD-зависимая изоцитратдегидрогеназа. Для ее действия необходимы ионы Mg2+ или Мn2+, а также ее положительный модулятор АDP, в отсутствие которого фермент практически не проявляет активности. Наличие в митохондриях изоцитратдегидрогеназы двух типов возможно, связано с регуляцией цикла.
г. а-Кетоглутарат окисляется до сукцината и СO2
На следующей стадии цикла происходит окислительное декарбоксилирование а-кетоглутарата с образованием сукцнил-СоА и СО2 (рис. 16-13), катализируемое а-кетоглутаратдегидрогеназным комплексом. Реакция описывается уравнением
![]()
Обратите внимание, что эта реакция практически идентична пируватдегидрогеназной реакции, о которой мы говорили выше; в обоих случаях речь идет об окислении а-кетокислоты, сопровождающемся утратой карбоксильной группы в виде СО2. И по структуре, и по функции а-кетоглутаратдегидрогеназный комплекс очень напоминает пируватдегидрогеназный комплекс. Он состоит из трех ферментов, аналогичных трем ферментам пируватдегидрогеназной системы, и включает также связанные с ферментами кофакторы: тиаминпирофосфат, Mg2+, кофермент A, NAD+, FAD и липоевую кислоту. Есть, однако, и важное различие: а-кетоглутаратдегидрогеназная система не имеет столь сложного механизма регуляции, какой характерен для пируватдегидрогеназного комплекса.
д. Превращение сукцинил-СоА в сукцинат
Сукцинил-СоА, продукт предыдущей стадии цикла, представляет собой высокоэнергетическое соединение. Гидролиз его тиоэфирной связи, так же как и гидролиз ацетил-СоА, характеризуется большой отрицательной величиной изменения стандартной свободной энергии.
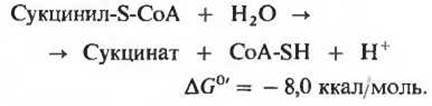
В клетке, однако, отщепление остатка СоА происходит не путем простого гидролиза, потому что такой путь означал бы растрачивание свободной энергии впустую. Разрыв тиоэфирной связи здесь сопряжен с реакцией, в ходе которой происходит запасание энергии с фосфорилированием гуанозиндифосфата (GDP) до гуанозинтрифосфата (GTP) (рис. 16-13):
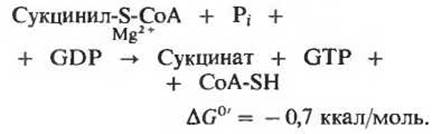
Участвующий в этой реакции фермент сукцинил-СоА — синтетаза катализирует образование свободного сукцината и одновременно с этим - образование концевой высокоэнергетической фосфатной группы GTP из GDP и Рі за счет свободной энергии, высвобождающейся при расщеплении сукцинил-СоА. У этой реакции, сопровождающейся запасанием энергии, есть промежуточный этап, во время которого происходит фосфорилирование самой молекулы фермента по одному из гистидиновых остатков в его активном центре. Именно богатая энергией фосфатная группа, участвующая в этом фосфорилировании, и переносится на GDP с образованием GTP. Сопряженное образование GTP за счет энергии, выделяющейся при окислительном фосфорилировании а-кетоглутарата, представляет собой еще один пример фосфорилирования на уровне субстрата. Вспомним, что нам уже знаком один пример фосфорилирования этого типа, а именно сопряженный синтез АТР за счет энергии, выделяющейся при окислении глицеральдегид-3-фосфата в ходе гликолиза (разд. 15.7,6). Подобные реакции принято называть фосфорилированием на уровне субстрата, потому что источником необходимой энергии служит для них окисление одного из органических субстратов. Объединяя реакции этого типа под общим названием, мы тем самым отличаем их от окислительного фосфорилирования, сопряженного с переносом электронов (его называют также фосфорилированием в дыхательной цепи; гл. 17).
GTP, образовавшийся под действием сукцинил-СоА-синтетазы, может затем передавать свою концевую фосфатную группу на ADP с образованием АТР; эта обратимая реакция катализируется нуклеозид-дифосфат-киназой (разд. 14.18)
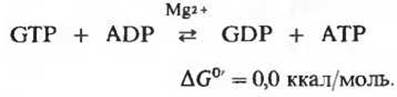
е. Дегидрирование сукцината с образованием фумарата
На следующей стадии цикла (рис. 16-13) сукцинат, образовавшийся из сукцинил-СоА, дегидрируется с образованием фумарата. Эта реакция катализируется флавопротеином сукцинатдегидрогеназой, молекула которого содержит ковалентно связанный флавинадениндинуклеотид. Эта простетическая группа, способная восстанавливаться, служит акцептором водорода в следующей реакции (Е означает здесь ферментный белок):
![]()
Сукцинатдегидрогеназа прочно связана с внутренней митохондриальной мембраной. Молекулярная масса фермента, выделенного из митохондрий бычьего сердца, равна приблизительно 100000. Одна молекула этого фермента содержит один остаток ковалентно связанного FAD и два железо-серных центра; в одном из этих центров находятся два атома железа, а в другом - четыре. В сукцинатдегидрогеназной реакции эти атомы железа изменяют свою валентность [Fe(II) — Fe(III)], и это позволяет считать, что они участвуют в переносе электронов (гл. 17).
Малонат является конкурентным ингибитором сукцинатдегидрогеназы (разд. 9.13 и рис. 16-7); выше мы отмечали, что изучение его действия в немалой мере способствовало выяснению общей схемы цикла лимонной кислоты.
ж. Фумарат гидратируется с образованием малата
Обратимая гидратация фумарата, вследствие которой образуется L-малат (рис. 16-13)
![]()
катализируется фумарат-гидратазой. Этот фермент, более известный под названием фумараза, был выделен в кристаллическом виде из сердца свиньи. Фумараза высокоспецифична: она гидратирует только транс-форму двойной связи фумарата и не действует на его цис-форму, а также ни на цис-, ни на транс форму монокарбоновых ненасыщенных кислот. В обратной реакции (L-малат→Фумарат) фумараза проявляет специфичность в отношении оптических изомеров; она неспособна катализировать дегидратацию D-малата. Молекулярная масса фумаразы равна приблизительно 200 000. Молекула фермента состоит из четырех субъединиц (четырех поли пептидных цепей). Кофермент для фумаразы не требуется.
з. Малат дегидрируется с образованием оксалоацетата
На последней стадии цикла лимонной кислоты NAD-зависимая L-малатдеги- дрогеназа, содержащаяся в матриксе митохондрий, катализирует дегидрирование L-малата с образованием оксалоацетата (рис. 16-13):
![]()
Равновесие этой реакции при стандартных условиях (т.е. при концентрациях всех компонентов 1 М и pH 7,0) сильно сдвинуто влево. Тем не менее в интактных клетках реакция идет слева направо, потому что продукт этой реакции, оксалоацетат, быстро удаляется (расходуется в цитрат-синтазной реакции) и его реальная концентрация в клетке остается все время крайне низкой, меньше 10-6 М.