ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
28. РЕГУЛЯЦИЯ ЭКСПРЕССИИ ГЕНОВ
Вопросы и задачи
1. Влияние стабильности мРНК и белка на регуляцию.
Предположим, клетки Е. соli растут в среде, где единственным источником углерода служит глюкоза. Затем в среду добавляют триптофан. Клетки продолжают расти и делиться каждые 30 мин. Опишите качественные изменения во времени уровня активности триптофансинтазы в клетках при следующих условиях:
а) мРНК триптофана стабильна (медленно разрушается на протяжении многих часов).
б) мРНК триптофана быстро расщепляется, но триптофансинтаза стабильна.
в) мРНК триптофана и триптофансинтаза быстро разрушаются.
2. Отрицательная регуляция.
Опишите возможное влияние на регуляцию генов lac-оперона следующих мутаций: (а) в lас-операторе делетирована большая часть О1; (б) мутация гена lacI, инактивирующая репрессор; (в) в промоторе изменена область вокруг позиции -10.
3. Специфичность связывания ДНК с регуляторными белками.
Типичный бактериальный репрессорный белок в 104 — 106 раз эффективнее связывается со специфическим участком ДНК (оператором), чем с неспецифической последовательностью ДНК. Для обеспечения эффективной репрессии достаточно 10 молекул репрессора на клетку. Предположим, в клетке человека есть очень похожий репрессор с такой же специфичностью к своему участку связывания. Сколько копий репрессора нужно, чтобы достичь такой же эффективности репрессии, как в бактериальной клетке? Подсказка. Геном Е. coli содержит около 4,6 млн п. н.; гаплоидный геном человека — около 3,2 млрд п. н.
4. Концентрация репрессора в Е. coli.
Константа диссоциации комплекса репрессор-оператор очень низкая (около 10-13 М). Клетка Е. coli (объем 2 • 10-12 мл) содержит 10 копий репрессора. Вычислите клеточную концентрацию белка-репрессора. Сравните эту величину с константой диссоциации комплекса репрессор-оператор. Каков смысл этого результата?
5. Катаболитная репрессия.
Клетки Е. coli растут в среде с лактозой, но без глюкозы. Укажите, повлияют ли перечисленные ниже изменения или условия на экспрессию lас-оперона (усилят, ослабят или не вызовут изменений). Возможно, полезно изобразить модель, описывающую каждую ситуацию.
а) Добавление глюкозы в высокой концентрации.
б) Мутация, предотвращающая отсоединение Lac-peпpeccopa от оператора.
в) Мутация, полностью инактивирующая β-галактозидазу.
г) Мутация, полностью инактивирующая галактозидпермеазу.
д) Мутация, препятствующая взаимодействию CRP с участком связывания вблизи промотора.
6. Аттенюация транскрипции.
Как изменится транскрипция trр-оперона Е. coli при следующих изменениях в лидерном участке мРНК триптофана?
а) Увеличение расстояния (числа оснований) между геном лидерного пептида и последовательностью 2.
б) Увеличение расстояния между последовательностями 2 и 3.
в) Удаление последовательности 4.
г) Замена двух кодонов Тrр в гене лидерного пептида на кодоны His.
д) Удаление участка связывания рибосомы в гене лидерного пептида.
е) Изменение нескольких нуклеотидов в последовательности 3, в результате чего она может спариваться с последовательностью 4, но не с последовательностью 2.
7. Репрессоры и репрессия.
Как может повлиять на SOS-ответ в Е. coli мутация гена lехА, которая предотвращает автокаталитическое расщепление белка LexA?
8. Регуляция путем рекомбинации.
Что произойдет с клетками, если рекомбиназа Hin в системе фазовой вариации у Salmonella станет более активной и будет осуществлять рекомбинацию (инверсию ДНК) несколько раз в каждой клеточной генерации?
9. Инициация транскрипции в клетках эукариот.
В грубом экстракте из экзотического гриба была обнаружена новая активность РНК-полимеразы. Эта РНК-полимераза инициирует транскрипцию с единственного специализированного промотора. При очистке полимеразы ее активность постепенно снижалась, а чистый фермент был полностью неактивным, если только в реакционную смесь не добавляли грубый экстракт. Объясните эти наблюдения.
10. Функциональные домены в регуляторных белках.
Биохимик заменил ДНК- связывающий домен дрожжевого белка Gal4 ДНК-связывающим доменом Lac-peпpeccopa и обнаружил, что сконструированный белок не ре
гулирует транскрипцию генов GAL в дрожжах. Изобразите схему функциональных доменов белка Gal4 и химерного белка. Почему химерный белок не регулирует транскрипцию генов GAL? Что нужно изменить в последовательности ДНК, с которой связывается химерный белок, чтобы он мог активировать транскрипцию генов GAL?
11. Модификация нуклеосом при активации транскрипции.
При подготовке участков генома к транскрипции происходит ацетилирование и метилирование специфических аминокислотных остатков гистонов в соответствующих нуклеосомах. Когда транскрипция завершена, необходимо вернуть модифицированные остатки в прежнее состояние. У млекопитающих метилирование остатков Arg в гистонах снимается под действием пептидиларгининдеиминаз. Однако в результате этой реакции образуется не неметилированный аргинин, а цитруллин. Каков второй продукт этой реакции? Предложите возможный механизм.
12. Механизмы наследования в развитии.
Яйца дрозофилы с генотипом bcd-/bcd- могут развиваться нормально, но взрослые насекомые с таким генотипом не производят жизнеспособного потомства. Объясните этот факт.
Биохимия в интернете
13. ТАТА-связывающий белок и ТАТА-бокс.
Чтобы исследовать взаимодействие между факторами транскрипции и ДНК, войдите в базу данных FirstGlance в Jmol на сайте http://firstglance. jmol.org и загрузите файл PDB ID 1TGH. Этот файл моделирует взаимодействия между ТАТА- связывающим белком человека и участком двухцепочечной ДНК. Когда структура загрузится, выберете опцию «Spin», чтобы молекула перестала вращаться. Далее нажмите ссылку «Contacts». При выборе функции «Chains» кликните на любую часть белка (цепь А голубого цвета), чтобы выбрать соответствующую цепь. Кликните «Show Atoms Contacting Target» и в появившемся списке найдите функцию «Show putatively hydrogen- bonded non-water» (показать возможные водородные связи не с водой), чтобы увидеть водородные связи между этим белком и ТАТА-боксом ДНК. Затем кликните на самую правую кнопку для получения изображения (Maximum detail: Target & Contacts Balls and Sticks, Colored by Element). Теперь вы сможете приближать и поворачивать структуру. Ответьте на следующие вопросы.
а) Какие пары оснований в ДНК образуют водородные связи с белком? Какие из них вносят вклад в специфическое узнавание ТАТА-бокса этим белком? (Длина водородной связи между донором и акцептором водорода находится в диапазоне 2,5-3,3 А).
б) Остатки каких аминокислот в белке взаимодействуют с этими парами оснований?
в) Какая последовательность ДНК представлена в этой модели и какие части этой последовательности узнаются ТАТА-связывающим белком?
г) Укажите зоны гидрофобных взаимодействий в этом комплексе. Они единичные или многочисленные? Чтобы ответить на этот вопрос, кликните на «Return to contacts» и воспользуйтесь опцией «Show hydrophobic (apolar van der Waals) interactions».
Анализ экспериментальных данных
14. Конструирование генетического переключателя в клетках Escherichia coli.
Регуляцию экспрессии генов часто описывают в терминах «включен/выключен», подразумевая при этом, что ген либо экспрессируется, либо не экспрессируется. На самом деле в подавлении и активации экспрессии играют роль лиганды, поэтому при промежуточном содержании регуляторных молекул может наблюдаться промежуточный уровень экспрессии. Например, рассмотрим уравнение связывания Lac-peпpeccopa, оператора и индуктора для laс-оперона Е. coli (см. рис. 28-7). Это сложный кооперативный процесс, однако в определенном приближении его можно описать с помощью следующего уравнения (R — репрессор, ИПТГ — индуктор, — изопропил-β-D-тиогалактозид):
![]()
Свободный репрессор R связывается с оператором и предотвращает транскрипцию laс-оперона; комплекс R-ИПTГ не связывается с оператором и, следовательно, транскрипция laс-оперона происходит.
а) С помощью уравнения (5-8) можно определить относительный уровень экспрессии белков laс-оперона как функцию концентра-
ции индуктора [ИПТГ]. Используйте эти расчеты для определения диапазона концентрации ИПТГ, когда уровень экспрессии изменяется от 10% до 90%.
б) На качественном уровне оцените содержание белков laс-оперона в клетках Е. coli до, вовремя и после действия ИПТГ. Не нужно указывать точное количество белка в точно определенные моменты времени, просто укажите тенденцию.
Гарднер, Кантор и Коллинс (2000) попытались создать «генетический тумблер» — систему регуляции генов с двумя ключевыми положениями, как у электрического выключателя. (А) В таком выключателе есть только два положения: включен — выключен; он не может поддерживать какую-то пониженную освещенность. В биохимических терминах это означает, что ген-мишень или группа генов (оперон) либо экспрессируется, либо не экспрессируется совсем, а промежуточный уровень экспрессии невозможен. (Б) Оба состояния устойчивы, вы можете изменять положение выключателя пальцем, но, когда вы отпускаете палец, выключатель остается в заданном положении. В биохимических терминах это означает, что под воздействием индуктора или другого сигнала экспрессия гена или оперона включается, или выключается и остается в этом состоянии и после прекращения сигнала.
в) Объясните, почему laс-оперон не обладает характеристиками А и Б.
Для создания «генетического тумблера» Гарднер с сотрудниками сконструировали плазмиду, состоящую из следующих элементов:
ОРlac. — область оператора и промотора laс- оперона Е. coli
ОРλ — область оператора и промотора фага λ
lacI — ген laс-репрессора, LacI. В отсутствие ИПТГ этот белок полностью подавляет ОРlас; в присутствии ИПТГ он позволяет осуществлять нормальную экспрессию с ОРlаc.
repts — ген мутантного термочувствительного белка-репрессора фага λ, reptts. При 37 °С этот белок полностью подавляет ОРλ; при 42 °С он позволяет осуществлять нормальную экспрессию с ОРλ.
GFP — ген зеленого флуоресцентного белка (GFP) — интенсивно флуоресцирующего маркерного белка (см. рис. 9-15 в т. 1)
Т — терминатор транскрипции
Эти элементы (см. рисунок) были размещены таким образом, что два промотора взаимно подавляли друг друга: ОРlас контролировал экспрессию rерts, а ОРλ контролировал экспрессию lacI. Состояние системы оценивали по уровню экспрессии GFP, который также находился под контролем ОРlас.
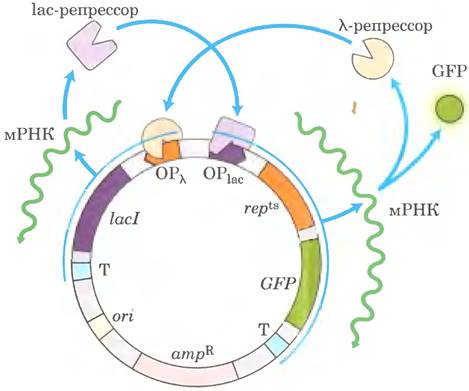
г) Сконструированная система могла находиться в двух состояниях: «GFР включен» (высокий уровень экспрессии) и «GFР выключен» (низкий уровень экспрессии). Опишите, какие белки присутствуют и какие промоторы экспрессируются в каждом из двух состояний.
д) Можно было ожидать, что обработка IРТG переведет систему из одного состояния в другое. Из какого в какое? Объясните свои рассуждения.
е) Можно было ожидать, что повышение температуры до 42 °С также вызовет переход системы из одного состояния в другое. Из какого в какое? Объясните свои рассуждения.
ж) Почему сконструированная плазмида должна была иметь описанные выше характеристики А и Б?
Для подтверждения того, что конструкция действительно обладала указанными характеристиками, Гарднер с соавторами сначала показали, что после включения выключения экспрессия GFР (высокая низкая) остается на том же уровне на протяжении длительного времени (свойство Б). Затем они измерили уровень GFР при разных концентрациях ИПТГ и получили следующие результаты.
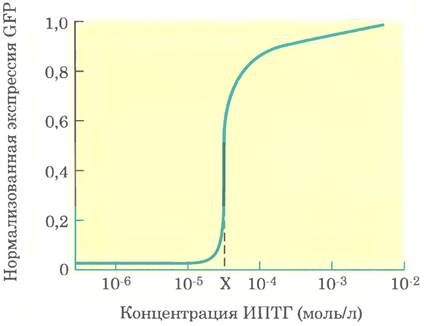
Оказалось, что средний уровень экспрессии GFР имел некое промежуточное значение при концентрации ИПТГ, равной X. Однако при измерении уровня экспрессии GFР в индивидуальных клетках при [ИПТГ] = X выяснилось, что уровень GFР был либо низким, либо высоким, но пи в одной клетке не было промежуточного уровня экспрессии этого белка.
з) Объясните, как это наблюдение подтверждает тот факт, что система обладает свойством А? Почему при [ИПТГ] = X в одних клетках наблюдается высокий, а в других низкий уровень экспрессии маркерного белка?