Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: кинетика
Константа равновесия
Поскольку все химические реакции обратимы, для обратной реакции (по отношению к той, когда n молекул А реагируют с m молекулами В)
АnВm→ nА + mВ
соответствующее выражение для скорости реакции будет иметь вид
Скорость реакции ∝ [AnAm].
Обратимость обозначается двойными стрелками:
nА + mВ ⇄ АnВm.
Это выражение следует читать: n молекул А и m молекул В находятся в равновесии с АnBm. Знак пропорциональности ∝ можно заменить на знак равенства, если ввести коэффициент пропорциональности к, характерный для рассматриваемой реакции. В общем случае
nА + mВ ⇄ AnBm
выражения для скорости прямой реакции (Скорость1) и обратной реакции (Скорость-1) принимают вид
![]()
Когда скорости прямой и обратной реакции равны, говорят, что система находится в равновесии:
![]()
Отсюда
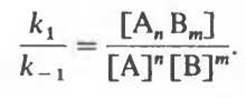
Отношение k1 к k-1, называется константой равновесия Keq. Следует запомнить следующие свойства системы, находящейся в состоянии равновесия
1 Строго говоря, должны использоваться не молярные концентрации, а молярные активности.
1. Константа равновесия равна отношению констант скоростей прямой и обратной реакций, k1/k-1.
2. В равновесии скорости прямой и обратной реакций (но не их константы) равны.
3. Равновесие является динамическим состоянием. Хотя суммарного изменения концентрации реагентов и продуктов в равновесии не происходит. А и В постоянно превращаются в АnВm, и наоборот.
4. Если известны равновесные концентрации А, В и АnВm, можно найти численное значение константы равновесия.
Связь между константой равновесия и изменением стандартной свободной энергии (∆G°) реакции
Константа равновесия связана с ∆G соотношением
∆G = -RTln Кеq.
Здесь R — газовая постоянная, Т — абсолютная температура. Поскольку их значения известны, зная численное значение Keq, можно найти ∆G°. Если константа равновесия больше единицы, реакция идет самопроизвольно, т. е. в том направлении, как она написана (слева направо). Если же константа равновесия меньше единицы, то самопроизвольно идет обратная реакция. Заметим, однако, что константа равновесия указывает направление, в котором реакция может идти самопроизвольно, но не позволяет судить, будет ли реакция идти быстро. Иными словами, она ничего не говорит о высоте энергетического барьера реакции (∆GF; см. выше). Это следует из того, что Кeq определяет только ∆G°. Скорости реакций зависят от высоты энергетического барьера, но не от величины ∆G°.
Большинство факторов, влияющих на скорости ферментативных реакций, оказывают свое действие путем изменения локальных концентраций реагентов.