Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: кинетика
Концентрация субстрата
Далее мы будем рассматривать ферментативные реакции, в которых имеется единственный субстрат и единственный продукт. Такая ситуация действительно наблюдается для некоторых ферментативных реакций, однако большинство из них протекает с участием двух и более субстратов и продуктов. Это, однако, нисколько не снижает ценности дальнейших рассуждений. То. что справедливо для одного субстрата, остается верным и для двух.
При увеличении концентрации субстрата [S] и сохранении всех остальных условий начальная скорость V (скорость, измеряемая в период, когда израсходована очень малая доля субстрата) будет повышаться до максимальной величины Vmax, после чего останется постоянной (рис. 8.14).
По мере повышения концентрации субстрата скорость будет расти до тех пор, пока не произойдет насыщения фермента субстратом. Измеренная в таких условиях начальная скорость уже не будет возрастать при дальнейшем повышении концентрации субстрата. Отметим, что субстрат обычно берут в значительном молярном избытке по отношению к ферменту. Например, если фермент с мол. массой 100 000 взаимодействует с субстратом с мол. массой 100 и оба присутствуют в концентрации 1 мг/мл, то на каждый моль фермента будет приходиться 1000 молей субстрата. Более реальными являются следующие величины:
[Enz] = 0,1 мкг/мл = 10-9 М,
[S] = 0,1 мг/мл = 10-3 М,
т.е. молярный избыток субстрата по отношению к ферменту составляет 106.
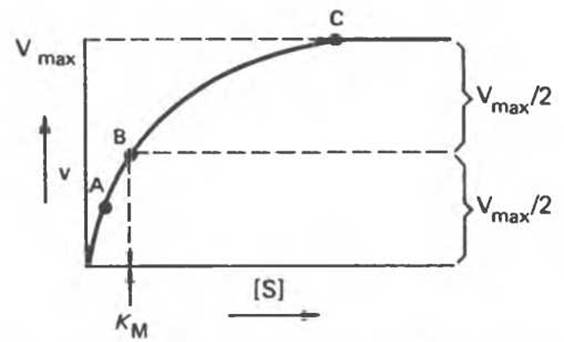
Рис. 8.14. Влияние концентрации субстрата на скорость ферментативной реакции.
Даже если [S] уменьшить в 100 раз, его концентрация все еще в 10000 раз будет превышать концентрацию фермента.
Ситуация, соответствующая точкам А, В и С на рис. 8.14, проиллюстрирована на рис. 8.15. В точках А и В в комплексе с субстратом находится лишь часть молекул фермента, хотя молекул субстрата намного больше, чем молекул фермента. Это происходит потому, что константа равновесия реакции Enz + S Enz — S (образование комплекса Enz — S) хотя и велика, но конечна. Таким образом, в точках А и В повышение или понижение [S] будет приводить к увеличению или уменьшению доли молекул Enz, связанных с S (т. е. доли молекул Enz — S), и v будет зависеть от [S]. В точке С практически все молекулы фермента связаны с субстратом, и дальнейшее повышение [S], хотя и повысит частоту столкновений Enz с S, не сможет привести к повышению скорости реакции — среди молекул фермента уже не будет таких, которые были бы свободны для реакции с субстратом.
Случай В представляет особый теоретический интерес, поскольку при этом ровно половина молекул фермента насыщена субстратом. Соответственно скорость равна половине максимальной скорости (Vmах/2), достижимой при данной концентрации фермента.