Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Пролин
Обмен пролина у млекопитающих
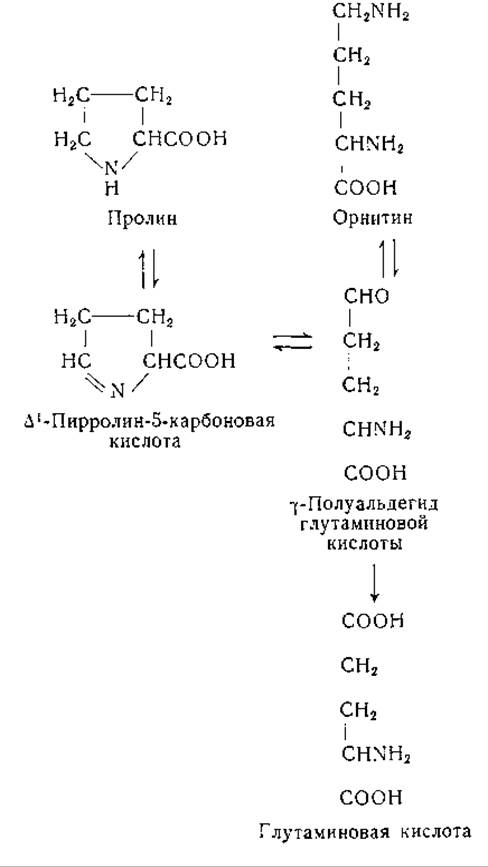
Взаимоотношения между пролином, глутаминовой кислотой и орнитином в. тканях млекопитающих сходны с теми, которые обнаружены у микроорганизмов. Первые указания на эти взаимоотношения были получены в исследованиях по биохимии питания (стр. 123); прямые доказательства дали опыты с применением изотопов. Так, например, у крыс после скармливания им меченой глутаминовой кислоты изотопная метка содержится в пролине и аргинине [355, 356]. При скармливании N15-пролина изотоп был обнаружен в глутаминовой кислоте, аргинине и орнитине [357]. Установлено также превращение орнитина, меченного дейтерием, в пролин и глутаминовую кислоту [358]. В опытах со срезами печени и почек было показано превращение пролина в глутаминовую кислоту [359, 360].
Исследована возможность образования при этих реакциях ряда промежуточных продуктов, в том числе а-кето-δ-аминовалерьяновой кислоты (или продукта ее циклизации — ∆1-пирролин-2-карбоновой кислоты), y-полуальдегида глутаминовой кислоты (∆1-пирролин-5-карбоновой кислоты), 2-пирролидон-5-карбоновой кислоты и а-амино-δ-оксивалерьяновой кислоты. Результаты опытов с Е. coli и срезами почек указывают на то, что а-амино-δ-оксивалерьяновая кислота, вероятно, не является промежуточным звеном. Хотя она используется Neurospora, но началу роста предшествует латентный период. По-видимому, при этом происходит превращение названной кислоты в более активное промежуточное соединение, вероятно в y-полуальдегид глутаминовой кислоты [345, 360, 361]. Данных, которые говорили бы в пользу промежуточного образования 2-пирролидон-5-карбоновой кислоты, нет, хотя известно, что L-изомер этого соединения быстро подвергается обмену в организме кроликов и может замещать глутаминовую кислоту в питании некоторых микроорганизмов [362]. В противоположность L-изомеру D-пирролидон-карбоновая кислота выводится с мочой после приема ее с пищей, а также после скармливания D-глутаминовой кислоты [363, 364].
а-Кето-δ-аминовалерьяновая кислота, являющаяся продуктом окислительного дезаминирования D-пролина и D-орнитина оксидазой D-аминокислот, идентифицирована в виде 2, 4-динитрофенилгидразона [365]. Этот гидразон был выделен также после окисления L-пролина оксидазой L-аминокислот из почек крысы [366]. Свободная а-кетокислота была получена путем окисли тельного дезаминирования δ-N-карбобензокси-L-орнитина посредством оксидазы L-аминокислот из яда змей; после удаления защитной группы устанавливается равновесие между а-кето-5-аминовалерьяновой кислотой и продуктом ее внутримолекулярной циклизации, ∆1-пирролин-2-карбоновой кислотой. Последнее соединение, по-видимому, не находится в равновесии с ∆1-пирролин-5-карбоновой кислотой. Рост некоторых мутантов Е. coli, нуждающихся в пролине, поддерживается ∆1-пирролин-5-карбоновой кислотой, но не может быть обеспечен ∆1-пирролин-2-карбоновой кислотой [292]. В настоящее время нет убедительных данных, указывающих на возможность образования а-кето-5-аминовалерьяновой кислоты в качестве промежуточного продукта при взаимопревращениях пролина, орнитина и глутаминовой кислоты.
Препараты почек кролика окисляют L-пролин в соединение, которое, вероятно, представляет собой у-полуальдегид глутаминовой кислоты [367, 368]. Это соединение было получено также при переаминировании между орнитином и рядом а-кетокислот в препаратах печени крысы (стр. 226). Совокупность данных говорит за то, что у-полуальдегид глутаминовой кислоты является промежуточным звеном в превращении пролин—орнитин—глутаминовая кислота, хотя это и не доказано однозначно.
После скармливания крысам N15-глицина в а- и 5-аминогруппах орнитина находили эквивалентные концентрации изотопа [369]. Эти результаты можно объяснить либо перемещением а-аминогруппы орнитина в 5-положение, либо тем, что источником образования обеих аминогрупп служит один и тот же азотистый предшественник. Стеттен [370] скармливала крысам в течение 9 дней DL-орнитин, меченный N15 в а- или δ-положении. В а-аминогруппы аргинина тканевых белков переходило очень мало изотопного азота из 5-аминогруппы орнитина. В образовании пролина эта группа участвовала в гораздо меньшей степени, чем а-аминогруппа, тогда как большая часть аминогрупп глутаминовой кислоты образовалась за счет 5-аминогруппы орнитина. Возможно, что на этих результатах отразилось в известной мере использование в опытах рацемических препаратов, орнитина. Однако появление в моче значительных количеств D-орнитина показывает, что большая часть D-орнитина не подвергалась превращениям в организме. Полученные данные согласуются с возможностью первоначального превращения орнитина в у-полуальдегид глутаминовой кислоты с переходом 5-аминогруппы в подвижный метаболический фонд азота, который, по-видимому, находится в равновесии с глутаминовой кислотой. Это объяснение согласуется с тем, что а-аминогруппа орнитина оказалась преимущественным предшественником азота пролина.
Пока не получено данных, подтверждающих или исключающих участие а-ацетил- или других а-ацилпроизводных глутаминовой кислоты или ее y-полуальдегида в обмене у млекопитающих. Восстановление y-полуальдегида глутаминовой кислоты в пролин в присутствии восстановленного дифосфопиридиннуклеотида было установлено в опытах с препаратами печени [1093]. Активность орнитин-трансаминазы обнаружена как в препаратах из тканей млекопитающих, так и у микроорганизмов (стр. 226). Совокупность данных указывает на наличие в организме животных следующих превращений: