Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Изолейцин, лейцин и валин
Распад моноаминокислот с разветвленной углеродной цепью
Пути распада валина, изолейцина и лейцина изучены в опытах с тканями млекопитающих. По-видимому, превращения этих аминокислот аналогичны: все они подвергаются переаминированию с образованием соответствующих а-кетокислот и затем необратимому окислительному декарбоксилированию с превращением остатков скелета в соответствующие ацилпроизводные кофермента А. В ранних исследованиях было установлено, что при превращении лейцина и изовалерьяновой кислоты в организме млекопитающих образуются кетоновые тела [413—415]. Отдельные этапы превращения лейцина в ацетоуксусную кислоту были выяснены при помощи изотопных методов и в последнее время — в исследованиях с ферментами. В опытах с изотопным углеродом установлено, что атомы С-1 и С-2 изовалерьяновой кислоты, соответствующие а- и ß-углеродным атомам молекулы лейцина, дают начало двухуглеродным остаткам, которые могут конденсироваться с образованием ацетоуксусной кислоты [416—419]. Углеродные атомы метальных групп изопропильного остатка становятся углеродными атомами метальной и метиленовой групп ацетоуксусной кислоты. у-Углеродный атом молекулы лейцина (или атом С-3 изовалерьяновой кислоты) переходит в карбонильный углерод ацетоуксусной кислоты. При этих исследованиях было доказано также включение СО2 в карбоксильную группу ацетоуксусной кислоты [418, 420]. Ферментативные опыты Куна и сотрудников [421—423, 1102] привели к установлению представленных ниже промежуточных продуктов и реакций:
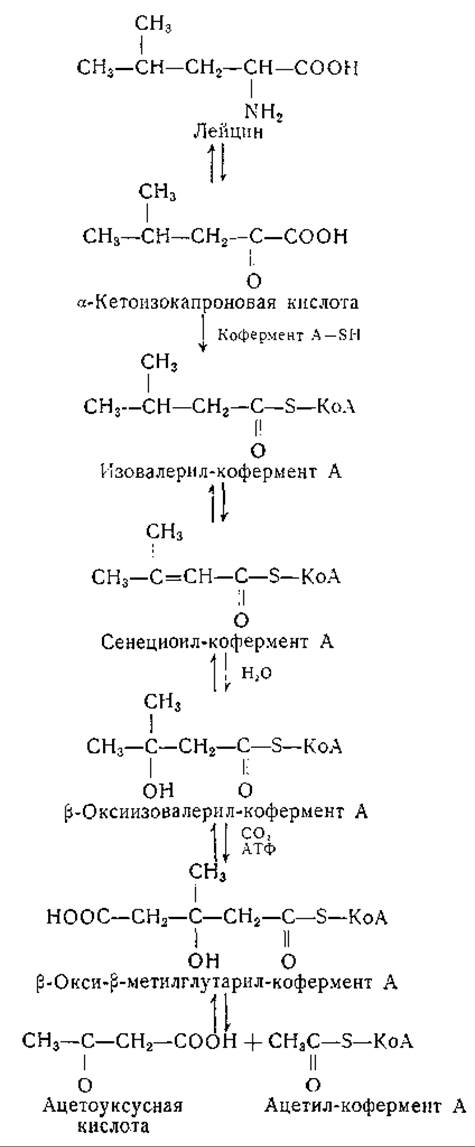
По аналогии с превращением пирувата в ацетилкофермент А предполагают, что при декарбоксилировании а-кетоизокапроновой кислоты образуется изовалерил-кофермент А, который окисляется до сенециоил-кофермента А (аналогично реакциям жирных кислот с неразветвленной цепью [424, 425]). Превращение сенециоил-кофермента А в ß-оксиизовалерил-кофермент А было показано в опытах с препаратами сердечной мышцы и с очищенными препаратами кротоназы печени — фермента, катализирующего взаимопревращение кротонил- в ß-оксибутирил-кофермента А. Присоединение СО2 к ß-оксиизовалерил-коферменту А с образованием ß-oкиcи-ß-мeтилглyтapил-кoфepмeнтa А происходит, по-видимому, при участии АТФ. ß-окси-ß-метилглутарил-кофермент А получен синтетически; он расщепляется препаратами из сердца свиньи (в присутствии цистеина или глутатиона) с образованием ацетоуксусной кислоты и ацетилкофермента А [426]. Приведенная схема распада лейцина находится в соответствии с известными кетогенными свойствами этой аминокислоты. Поскольку реакция декарбоксилировании в этом процессе необратима, эта схема согласуется с тем, что животные не могут синтезировать лейцин из каких-либо промежуточных продуктов обмена, за исключением соответствующей ему а-кетокислоты (или а-оксикислоты).
Согласно данным Куна [421], АТФ, возможно, реагирует с СО2, образуя «активированную» двуокись углерода, способную присоединяться к ß-оксиизовалерилкоферменту А с образованием ß-окси-ß-метилглутарил-кофермента ∆1:
![]()
1 В 1959 г. Ф. Линен и сотрудники установили, что «активированная углекислота», возникающая в процессах обратимого ферментативного декарбоксилирования-карбоксилирования, представляет собой лабильный продукт присоединения СО2 к остатку биотина в биотинсодержащих ферментах. В описанном выше превращении лейцина в ацетоуксусную кислоту участвует биотиновый фермент (карбоксилаза ß-метилкротонил-кофермента А); его карбоксипроизводное (СОО--биотин-энзим) переносит карбоксильный остаток на ß-метил-кротонил-кофермент А (сенециоил-кофермент А в приведенной выше схеме) с образованием метилглутаконил-КоА, который затем присоединяет молекулу воды, превращаясь в ß-окси-β-метилглутарил-КоА (F. Lynen et al., Angewandte Chemie, 71, 481, 1959). — Прим. ред.
Распад валина происходит путем цепи ферментативных реакций, сходных с реакциями, участвующими в обмене лейцина, однако конечные продукты превращений этих аминокислот различны. Уже давно известно, что валин служит источником образования гликогена [427—430]. Судя по данным опытов с использованием изотопов, валин расщепляется с образованием кислоты с трехуглеродной цепью, которая может участвовать в синтезе гликогена [429, 430]. Схема превращений валина, приведенная ниже, согласуется с экспериментальными данными [421, 423, 431]:
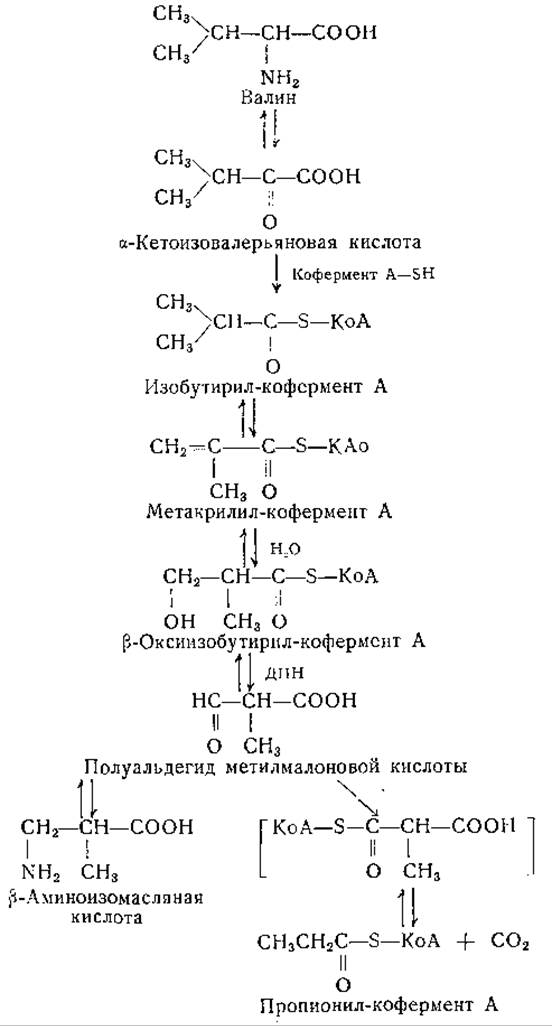
Образование метакрилил-кофермента А предполагается по аналогии с промежуточными реакциями распада лейцина. Опыты с ферментными препаратами свидетельствуют о возможности гидратирования этого соединения с образованием ß-окси-изобутирил-кофермента А. Изобутирильный остаток этого соединения, вероятно, превращается в пропионовую кислоту [432], углеродные атомы которой имеют источником изопропильную группу валина. ß-Оксиизобутирил-кофермент А, по-видимому, превращается в ß-оксиизомасляную кислоту, которая может переходить в полуальдегид метилмалоновой кислоты. Для последнего соединения возможно переаминирование с образованием ß-аминоизомасляной кислоты (являющейся также продуктом распада тимина) или окисление в метилмалоновую кислоту. Описано карбоксилирование пропионил-кофермента А при участии СО2 [433].
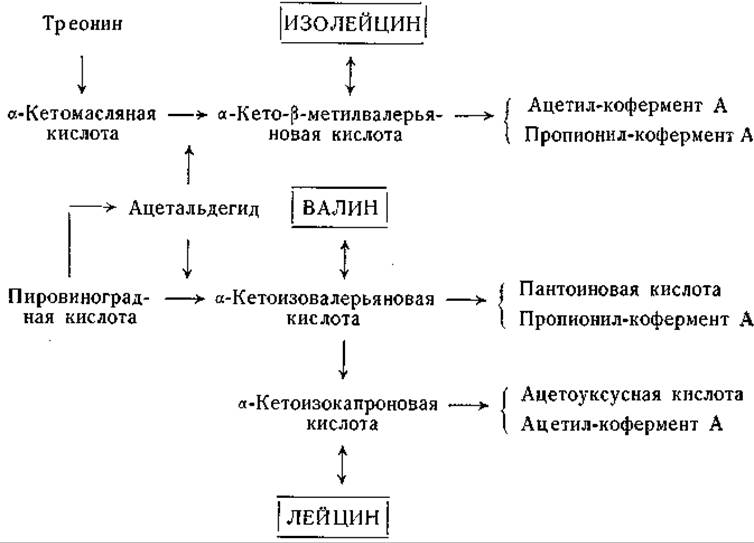
Фиг. 15. Сводная схема превращений изолейцина, лейцина и валина.
При некоторых условиях изолейцин обладает кетогенными свойствами, при других условиях он превращается в углеводы [434—436]. Кун и сотрудники [421, 423, 437—439] в своих исследованиях установили, что в срезах печени при распаде лейцина образуются как двухуглеродные, так и трехуглеродные фрагменты. Дальнейшие исследования этих авторов свидетельствуют в пользу приведенной ниже цепи превращений изолейцина:
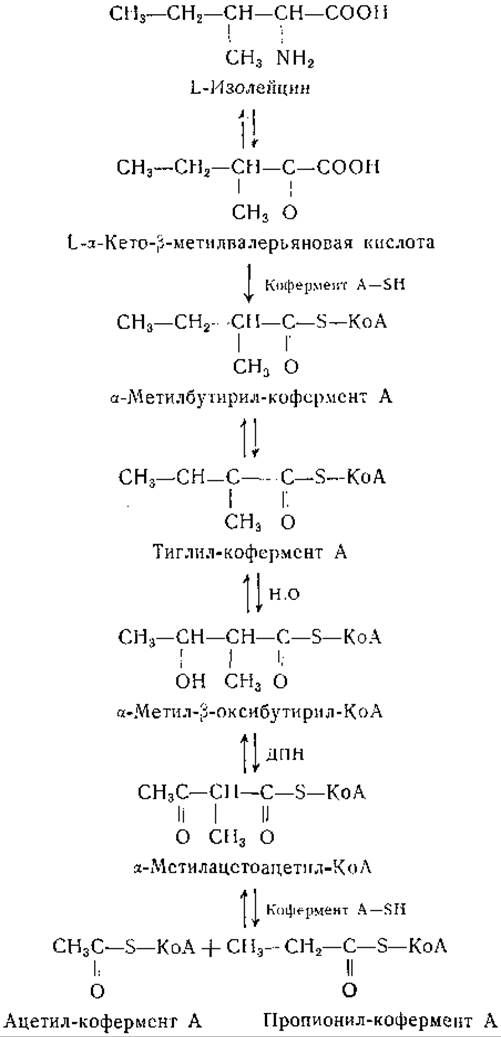
Изолейцин превращается в а-кетокислоту, при окислительном декарбоксилировании которой образуется а-метилбутирил-кофермент А. Кун и его сотрудники нашли, что тиглиновая кислота (цис-2-метилкротоновая кислота) гидратируется препаратами из печени и сердца или очищенной кротоназой. Превращение тиглил-кофермента А в ацетил-кофермент А предполагается на основании образования лимонной кислоты в системах, содержащих щавелевоуксусную кислоту и ДПН. Последние две реакции приведенной выше схемы представляются вероятными по аналогии с промежуточными реакциями на пути окисления жирных кислот с неразветвленной цепью [440] и недавно доказаны экспериментально [439]. Из сердца свиньи получена очищенная трансфераза кофермента А, катализирующая следующую реакцию:
![]()
Аминокислоты с разветвленной цепью являются, вероятно, предшественниками некоторых родственных им по структуре природных соединений. Так, например, у Е. coli [441, 442] из а-кетоизовалерьяновой кислоты образуется пантоиновая кислота:
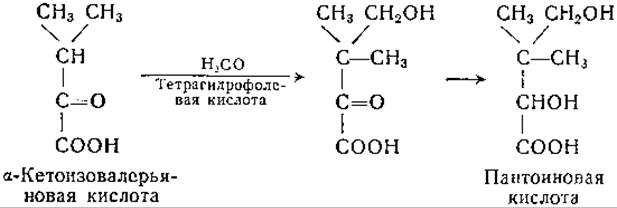
Имеется сообщение о наличии в гидролизатах Е. coli [433] а-аминоаналога пантоиновой кислоты, однако Маас и Дэвис [444] оспаривают эти данные.
Образование пантотеновой кислоты изучали с применением полученного из Е. coli очищенного фермента [445, 446], который катализирует образование пантотената из АТФ, пантоината и ß-аланина. Экспериментальные данные указывают на то, что в этой реакции промежуточным звеном является образование связанного с ферментом комплекса пантоиновой и адениловой кислот (см. стр. 311). Можно отметить, что в построении молекулы кофермента А принимают участие по крайней мере шесть аминокислот [1103]:
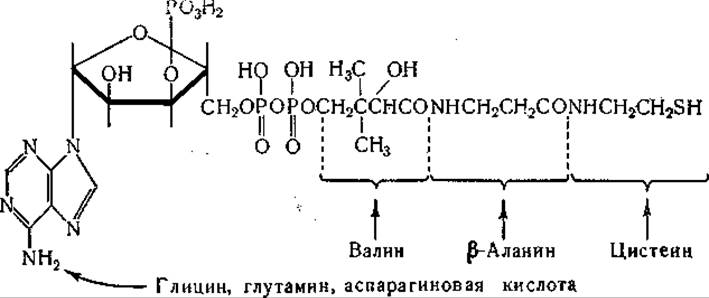
Валин служит также предшественником пенициллина (стр. 273). Роль лейцина, изолейцина и валина в образовании соединений с разветвленной цепью, участвующих в синтезе холестерина и каучука, рассматривалась на симпозии, посвященном этой проблеме [447]. Отмечалось также, что эти аминокислоты могут участвовать в образовании каротиноидов [448]. Недавно ß-метил-масляная и d-а-метилмасляная кислоты были обнаружены в жировой смазке шерсти собаки. Предполагают, что эти кислоты происходят из лейцина и соответственно изолейцина [449].
Хассан и Гринберг [450] исследовали превращения DL-норлейцина и DL-норвалина, меченных С14, в организме крысы. Судя по выделению радиоактивной СO2, эти аминокислоты распадались довольно быстро, но в белки они, по-видимому, не включались. Гринберг [451] дает следующую схему катаболизма норвалина и норлейцина:
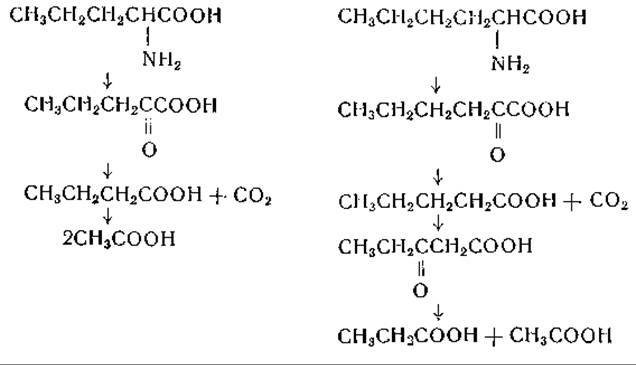
Первой ступенью в этих цепях реакций является переаминирование, приводящее к образованию а-кетокислот; эти реакции были показаны в ряде систем (табл. 22). Остальные этапы аналогичны реакциям окисления жирных кислот и реакциям окислительного распада аминокислот с разветвленной цепью.