Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Изолейцин, лейцин и валин
Биосинтез
Превращения этих трех аминокислот с разветвленной углеродной цепью для удобства можно обсуждать совместно. Первую ступень распада этих аминокислот и последнюю ступень в их биосинтезе представляют реакции переаминирования (см. стр. 210). Ниже обсуждается преимущественно обмен углеродных скелетов этих аминокислот.
Боннер и сотрудники [384] выделили мутант Neurospora crassa, нуждающийся для роста в изолейцине и валине, и это явилось отправной точкой для ряда исследований, посвященных биосинтезу названных аминокислот. Благодаря применению изотопных, ферментативных и генетических методов мы довольно хорошо осведомлены о главных ступенях биосинтеза валина, изолейцина и лейцина.
Результаты ранних исследований на мутантах Neurospora и Escherichia coli показали, что ближайшими предшественниками валина и изолейцина являются а-кетоизовалерьяновая и соответственно а-кето-β-метилвалерьяновая кислоты [354, 385—387]. Были получены мутанты с абсолютной потребностью в изолейцине и частичной — в валине. Такие организмы не растут при добавлении соответствующих а-кетокислот; мало того, они накапливают а-кетоаналоги валина и изолейцина при выращивании на среде, содержащей минимальные количества этих двух аминокислот [387, 388]. На основании изучения условий роста таких мутантов можно заключить, что у них нарушена реакция переаминирования в биосинтезе изолейцина. Проверка ферментативной активности подтвердила, что мутанты лишены трансаминазы, катализирующей образование изолейцина из а-кето-β-метилвалерьяновой кислоты [390]. Отсутствием этого фермента обусловлена также частичная потребность мутанта в валине. Клетки мутанта и дикого штамма могут синтезировать некоторое количество валина путем переаминирования между а-кетоизовалерьяновой кислотой и аланином или а-аминомасляной кислотой, но активность трансаминазы, участвующей в этой реакции, недостаточна для снабжения мутанта валином в количестве, необходимом для оптимального роста [390, 391]. При повторных пересевах мутанта на среде с низкой концентрацией валина наблюдается повышение активности валин-аланин-трансаминазы. Такие культуры не требуют (или почти не требуют) дополнительного снабжения валином для оптимального роста [391]. После обнаружения этих ферментных систем было найдено, что в питании первоначально использованных мутантов аланин и а-аминомасляная кислота могут замещать валин; эти данные согласуются со схемой, предложенной рядом авторов [390, 391]. Другие особенности системы трансаминаз, участвующих в этих превращениях, рассмотрены в гл. III (стр. 210).
Вероятными предшественниками а-кето-β-метилвалерьяновой и а-кетоизовалерьяновой кислот являются а, ß-диоксикислоты, накапливающиеся в культурах некоторых мутантов, у которых блокирован этап биосинтеза, предшествующий реакции переаминирования [392—394]. Такие мутанты могут расти при добавлении соответствующих диоксикислот; фермент, дегидратирующий эти диоксикислоты с образованием а-кетокислот, был выделен как из Е. coli, так и из N. crassa. В настоящее время показано, что образование а-кетоизовалерьяновой и а-кето-ß-Meтилвалерьяновой кислот катализирует один и тот же фермент [395, 396].
Ряд исследований указывал на наличие взаимосвязей треонина, а-аминомасляной кислоты и соответствующих им а-кетокислот с изолейцином и валином. Так, например, изолейцин-дефектные мутанты Е. coli могут использовать для роста L- и D-треонин, гомосерин или а-аминомасляную кислоту [386 397]. Было показано, что при этом углерод треонина действительно представляет источник четырех углеродных атомов в молекуле изолейцина [396, 398] (стр. 335).
В изотопных исследованиях, проведенных на Neurospora и на Torula utilis, получены новые важные данные о происхождении диоксикислот, играющих роль предшественников а-кетоизовалерьяновой и а-кето-β-метилвалерьяновой кислот. На основании опытов с С14-уксусной кислотой было высказано предположение, что прямые четырехуглеродные цепи в молекулах валина и изолейцина имеют общее происхождение [399]. Однако дальнейшие исследования, выполненные в двух лабораториях, показали, что углеродные остовы валина и изолейцина имеют различное происхождение, хотя реакции, участвующие в их образовании, сходны. Страссмен и сотрудники [400, 401] изучали у Т. utilis включение углерода молочной кислоты в валин. Оказалось, что углерод карбоксильной группы молочной кислоты переходит только в карбоксильную группу валина, тогда как а-углеродный атом молочной кислоты является предшественником атомов С-2 и С-3 валина; углерод метальных групп валина имеет источником а-углеродный атом молочной кислоты. Особенно существенно наблюдение, что атомы С-2 и С-3 молекулы валина происходят оба от а-углеродного атома молочной кислоты; это свидетельствует об образовании связи между а-углеродными атомами двух молекул молочной кислоты в процессе образования валина. Возможный механизм превращения показывает нижеследующая схема:
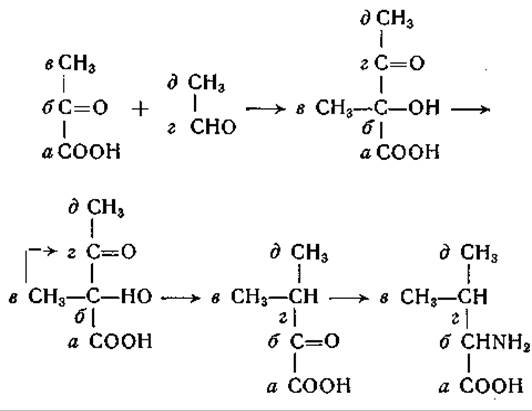
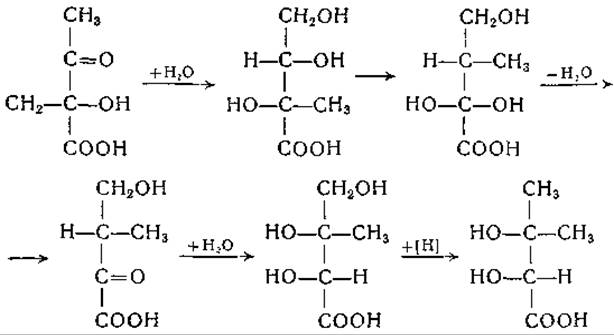
Согласно этой схеме, пировиноградная кислота конденсируется с ацетальдегидом в а-ацетомолочную кислоту, у которой в результате превращения типа пинаколиновой перегруппировки метальная группа перемещается из a-положения в ß-положение. Путем перегруппировки из а-ацетомолочной кислоты может образовываться и а-кето-β-оксиизовалерьяновая кислота, которая также может служить предшественником валина:
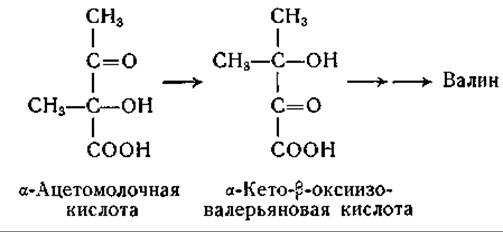
Эдельберг [396], опираясь на данные исследований о биосинтезе валина у Neurospora, предполагает аналогичную внутримолекулярную перегруппировку; его схема несколько отличается от схемы, приведенной выше:
Эта цепь реакций поясняет образование диокислоты в качестве предшественника валина. Обе схемы согласуются с экспериментальными данными об образовании скелета валина и пировиноградной кислоты из углеродных атомов уксусной кислоты и СО2 [402—404].
Имеются данные, которые свидетельствуют о том, что синтез изолейцина происходит аналогичным путем. Предполагают, что ацетальдегид, образующийся из пировиноградной кислоты, конденсируется с а-кетомасляной кислотой. Последующие превращения аналогичны реакциям, приведенным выше для валина [398, 403, 405, 406]. Возможно также, что первоначально конденсируются пировиноградная и а-кетомасляная кислоты с образованием семичленного промежуточного продукта, подвергающегося декарбоксилированию после перемещения боковой цепи. При биосинтезе валина также возможна аналогичная конденсация двух молекул пировиноградной кислоты. Данные опытов с мечеными предшественниками согласуются с изложенными выше предположениями, однако выяснение истинной природы промежуточных продуктов и их превращений остается задачей будущих исследований. Страссмен и Вайнхауз [407] рассчитали теоретическое распределение углеродных атомов метильной и карбоксильной групп уксусной кислоты в молекуле синтезируемого изолейцина, исходя из допущения, что источником а-кетомасляной кислоты является аспарагиновая кислота, которая в свою очередь образуется из щавелевоуксусной кислоты через цикл лимонной кислоты. Наблюдаемое распределение метки в выделенном изолейцине хорошо согласуется с рассчитанными величинами. Предусматриваемые приведенными выше схемами перемещения метильной и этильной групп представляют собой реакции нового типа, по крайней мере для биологических систем, и доказательство таких превращений в опытах с ферментными препаратами представляло бы большой интерес. В литературе имеются данные о возможной миграции алкильных групп в других биологических системах, например при циклизации сквалена [401, 408, 409, 412].
О роли треонина как предшественнике изолейцина свидетельствуют опыты, показавшие, что углерод треонина появляется в синтезируемом микроорганизмами изолейцине ([396], см. также [237]). Треонин является источником углеродных атомов изолейцина в положениях 1, 2, 5 и 6, причем углеродные атомы 1 и 2 треонина переходят в соответствующие углеродные атомы молекулы изолейцина:
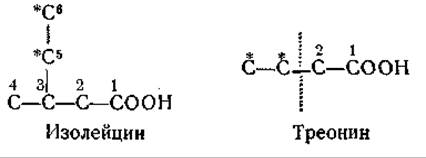
Эти данные можно объяснить возможным расщеплением треонина на двухуглеродные фрагменты и рассмотренным выше процессом внутримолекулярной перегруппировки. Треонин, по-видимому, является обязательным предшественником изолейцина у Е. coli [1100]. Найдено, что некоторые мутанты, нуждающиеся для роста в изолейцине, не содержат L-треониндегидратазы [1101] и, следовательно, не способны превращать треонин в а-кетомасляную кислоту, необходимую для образования изолейцина.
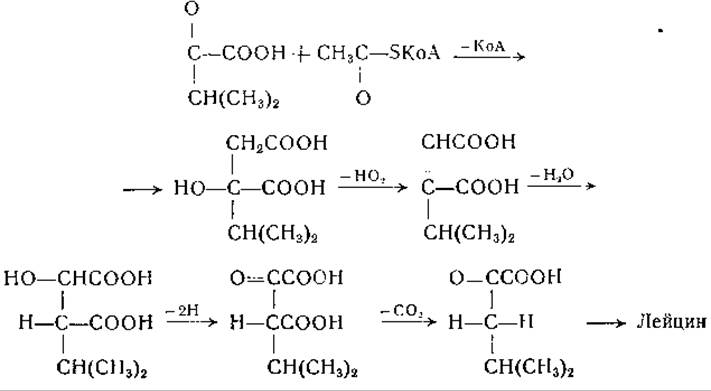
Синтез лейцина был изучен в опытах на Т. utilis с использованием меченых уксусной и молочной кислот [410]. Полученные данные указывают на то, что лейцин синтезируется из уксусной кислоты и изобутирильного остатка валина (см. также [411]). Результаты исследования конкурентных отношений между предшественниками лейцина, проведенного на Е. coli с применением изотопных индикаторов [117], говорили о том, что а-кетоизовалерьяновая кислота может служить предшественником лейцина. Страссмен и сотрудники [410] высказали предположение, что происходит конденсация а-кетоизовалерьяновой кислоты с углеродом метильной группы ацетилкофермента А с образованием а-окси-а-изопропилянтарной кислоты, которая превращается в а-кетоизокапроновую кислоту. Это превращение аналогично превращению лимонной кислоты в а-кето- глутаровую кислоту. Из а-кетоизокапроновой кислоты образуется путем переаминирования лейцин: