Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Оксипролин
L-Оксипролин был найден в кислотных гидролизатах немногих белков, в частности в коллагене и в меньших количествах в эластине. Распространение его в природе, очевидно, ограничивается преимущественно белками соединительной ткани животных. Значение оксипролина в строении коллагена рассмотрено в статье Густавсона [1094]. До сих пор не найдено организмов, нуждающихся для роста в этой аминокислоте. При выращивании Sarcina lutea в присутствии оксипролина он накапливается в клетках и в культуральной среде этого микроорганизма [374]. алло-L-Оксипролин был найден в сандаловом дереве (в свободном состоянии) и в кислотных гидролизаторах фаллоидина (стр. 61). Недавно установлено присутствие оксипролина в кислотных гидролизатах белков из ткани моркови, растущей в тканевой культуре [1095].
После введения крысам в течение трех дней пролина, меченного N15 и дейтерием, среди выделенных из тушки аминокислот наиболее интенсивно меченным оказался оксипролин (если не считать самого пролина). Отношение N15: D в выделенном оксипролине показывало, что превращение пролина в оксипролин сопровождалось потерей примерно половины дейтерия, связанного с атомами углерода в молекуле пролина [357]. Эти данные указывают на прямое превращение пролина в оксипролин, но не исключают возможности существования других путей биосинтеза оксипролина. Когда крысам скармливали рацемический N15-оксипролин, лишь около 0,3% оксипролина, выделенного из тушки, имело метку [375]. Эти результаты согласуются с малой скоростью обновления коллагена (стр. 274); однако при введении крысам меченого пролина в оксипролин тушки включалось значительно больше изотопа, чем при скармливании меченого оксипролина. Меченый азот оксипролина, введенный с пищей, переходил во многие аминокислоты тела, в особенности в глутаминовую и аспарагиновую кислоты. Эти данные указывают на быстрый распад оксипролина в организме крысы. На основании этих результатов Стеттен [375] предполагает, что большая часть оксипролина в тканях животного образуется, вероятно, из пролина, входящего в состав пептидных цепей, а не из свободного оксипролина.
Виткоп и сотрудники [1096, 1097] изучали различные соединения, которые могли бы участвовать в обмене пролина и оксипролина, в том числе y-оксиорнитин и y-кетопролин:
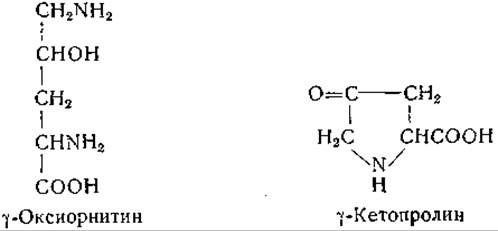
Виткоп и Бейлер [1097] осуществили химическим путем превращение стереоизомеров y-оксиорнитина в соответствующие изомеры оксипролина.
Вполне вероятно, что оксипролин у крысы образуется из пролина; обратная реакция, по-видимому, не протекает в сколько-нибудь значительном масштабе, так как оксипролин в противоположность пролину не замещает аргинин в диете, предназначенной для обеспечения оптимального роста молодых крыс [376]. Оксипролин не обеспечивает рост мутантов Escherichia coli, нуждающихся в пролине [377]. Между тем было найдено, что у этого организма оксипролин конкурирует с глюкозой в синтезе пролина [239]. Природа этого интересного эффекта неясна. Если в препаратах оксипролина, использованных в этих опытах, присутствовала небольшая примесь пролина, то одно это могло бы объяснить полученные результаты.
Уже давно установлено, что оксипролин обладает гликогенетическим действием [379, 380]. Данные, полученные in vitro, свидетельствуют о превращении его в глутаминовую кислоту и глутамин [359]. Исследования Стеттен [357—375] согласуются с этим представлением. Крысам вводили DL-оксипролин, меченный С14 по а-углеродному атому. Среди аминокислот, выделенных из тканей, наибольшая удельная активность была обнаружена в глутаминовой кислоте; в аспарагиновой кислоте и оксипролине содержалось примерно одинаковое количество изотопа, а в пролине его было совсем мало. В глутаминовой кислоте наибольшая концентрация изотопа была найдена в а-углеродном атоме; эти данные указывают на превращение оксипролина в глутаминовую кислоту [381]. В недавних исследованиях с меченым оксипролином получены указания на существование двух путей его обмена. Один путь приводит к образованию глутаминовой кислоты, а другой — к образованию аланина или близкого к нему соединения [1098].
Адамс [1091] изучал обмен оксипролина у адаптированного штамма Pseudomonas. В растворимых экстрактах из этого организма как L-оксипролин, так и алло-D-оксипролин превращались в глутаминовую кислоту. D-Оксипролин и алло-L-оксипролин практически не подвергались превращению. В виде глутаминовой кислоты была обнаружена только половина утилизированного оксипролина.
Исследования с применением препаратов печени и почек показали, что L-пролин окисляется через глутаминовую кислоту до СО2 и NH3. Участвующий в этом процессе фермент, пролин-оксидаза, действует также на L-оксипролин [367, 1092]; по-видимому, она отличается от оксидазы L-аминокислот. Оксипролин окисляется в этой системе не до конца; в процессе окисления накапливается продукт, 2,4-динитрофенилгидразон которого является, как предполагают, производным у-полуальдегида у-оксиглутаминовой кислоты. Имеющиеся данные не позволяют судить о природе промежуточных продуктов, образующихся в процессе превращения оксипролина в глутаминовую кислоту.
D-Аминокислотная оксидаза почек окисляет D-пролин в а-кето-3-аминовалерьяновую кислоту [365] и в отсутствие каталазы — в y-аминомасляную кислоту [382]; при окислении же D-оксипролина или алло-D-оксипролина в присутствии каталазы образуется пиррол-2-карбоновая кислота [382]. Образование пиррол-2-карбоновой кислоты из промежуточного продукта окисления (вероятно, из соответствующей а-кетокислоты, находящейся в равновесии со своей циклизованной формой) происходит неферментативным путем и катализируется кислотами:
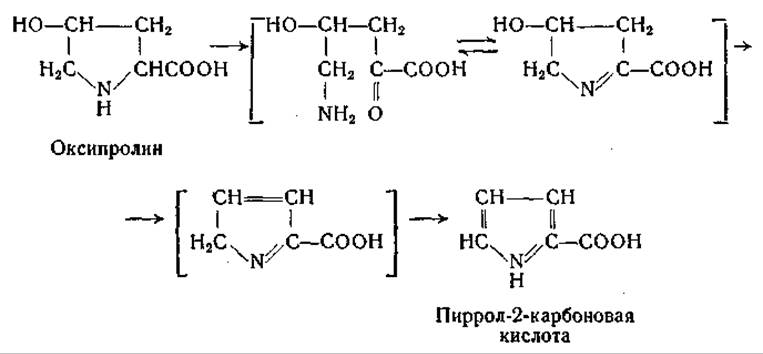
Пиррол-2-карбоновая кислота была найдена также в числе продуктов расщепления мукопротеидов и сиаловой кислоты [383, 1099].
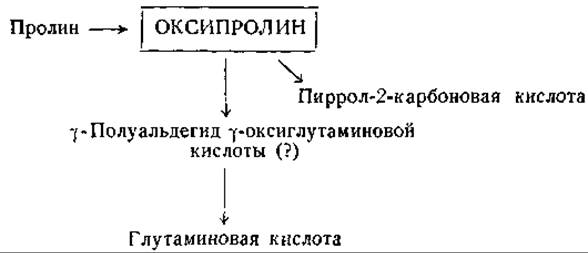
Фиг. 14. Сводная схема превращений оксипролина.