Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Метионин и цистеин
Трансметилирование
Деметилирование метионина с образованием гомоцистеина и обратное превращение являются важными процессами обмена. Опыты по кормлению крыс гомоцистеином показали, что как D-, так и L-изомер могут поддерживать рост в отсутствие метионина [456, 490]. Однако при некоторых рационах с недостаточным содержанием метионина гомоцистеин не обеспечивает рост, если к рациону не добавляется холин или иной донатор метальной группы [491—493]. Представление о переносе метальных групп, или трансметилировании, было выдвинуто впервые Гофмейстером в 1894 г. [494]; в исследованиях по биохимии питания оно получило экспериментальное подтверждение. Превращение метионина в гомоцистеин связано с образованием подвижной метальной группы, способной метилировать, например, такое соединение, как гуанидинуксусная кислота, с образованием креатина [495]. Другими примерами трансметилирования являются процессы переноса метальной группы от холина к гомоцистеину с образованием метионина и от метионина к карнозину с образованием ансерина [1107]. По данным Дю-Виньо и сотрудников, метильная группа переносится целиком: в процессе переноса метального остатка, меченного изотопами углерода и водорода, не происходило потери дейтерия [496]. Однако концепция, согласно которой необходимо введение метальных групп с пищей, потребовала пересмотра, так как ряд наблюдений показал, что диеты, не содержащие метионина или других донаторов метальных групп, но содержащие гомоцистеин и оптимальные количества витамина В12 и фолевой кислоты, могут обеспечивать рост крыс [493, 497—501]. По-видимому, в диетах, использованных в ранних исследованиях [40], было недостаточным содержание витамина В12 и фолевой кислоты, участвующих, как в настоящее время установлено, в синтезе метальных групп. В опытах с крысами, выращенными в асептических условиях [501] (см. также [502—607]), было окончательно доказано, что синтез метальных групп протекает в тканях животного, а не под действием микрофлоры кишечника. В этих опытах стерильные крысы получали рацион, не содержащий холина, с добавлением D2О в течение 10—23 дней. Концентрация дейтерия в метальных группах холина, выделенного из тканей, была значительно выше, чем средняя концентрация дейтерия в теле. Это указывает на то, что в тканях происходил синтез метальных групп [501].
Образование метионина из гомоцистеина может происходить путем переноса подвижных метальных групп от различных соединений — холина, бетаина и диметилпропиотетина. Борсук и Дубнов [508] исследовали перенос метальных групп от холина к гомоцистеину в тканевых препаратах печени и нашли, что бетаин является более активным донатором метальной группы, чем холин. Установлено, что при анаэробных условиях источником метильной группы может служить только бетаин, но не холин [509] и что для реакции с холином необходимо наличие в инкубируемой системе холиноксидазы [510]. Холин как таковой не является донатором метильной группы, но превращается через бетаинальдегид в бетаин, который и служит донатором метального остатка [511]. При инкубировании с препаратами печени крысы и гомоцистеином холин переходит в диметилглицин, а не в диметиламиноэтанол [510]. Доказано также, что у высших растений синтез бетаина происходит главным образом путем окисления холина [512, 513]:
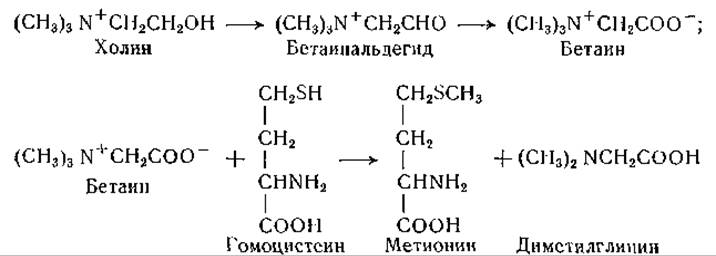
В исследованиях с применением N15-бетаина показано, что атом азота этого соединения служит предшественником глицина, что указывает на полное деметилирование бетаина [514]. Описаны реакции трансметилирования с участием тетинов, например диметил-β-пропиотетина, диметилтетина [515, 516] и солей метилметионинсульфония [517—519].
Реакции трансметилирования с участием «ониевых» соединений, таких, как бетаин или диметилтетин, не требуют наличия аденозинтрифосфата или других источников энергии. В противоположность этому процессы метилирования никотинамида за счет метионина [520, 521], метилирования норадреналина [522] и метилирования гуанидинуксусной кислоты [523—525] происходят только в присутствии аденозинтрифосфата. Для этих реакций необходимо «активирование» метионина аденозинтрифосфатом, которое, как показал Кентони [526—530, 1108], протекает согласно следующему уравнению:
![]()
«Активный метионин» имеет следующее строение:
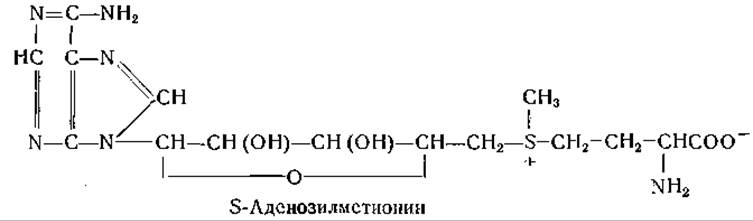
Кентони очистил фермент, катализирующий активирование метионина, и показал, что S-аденозилметионин может служить донатором метальной группы в отсутствие аденозинтрифосфата. В частности, метилирование гуанидинуксусной кислоты с образованием креатина протекает следующим путем:
![]()
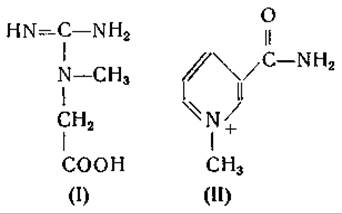
Реакция катализируется ферментом — метидферазой гуанидинуксусной кислоты. Установлено образование S-аденозилгомоцистеина; дальнейшие превращения этого соединения подлежат изучению. Метилирование никотинамида в N'-метилникотинамид происходит аналогичным путем, но под действием другого фермента — метилферазы никотинамида. Образованию креатина из гуанидинуксусной кислоты сопутствует образование иона водорода, чего не наблюдается при метилировании никотинамида. Кентони объясняет это различие тем, что при синтезе гуанидинуксусной кислоты возникает третичный амин (I), тогда как при метилировании никотинамида образуется новое «ониевое» соединение (II), содержащее метилпиридиниевую группировку:
S-Аденозилметионин является, вероятно, предшественником 5'-тиометиладенозина который содержится в различных микроорганизмах, в том числе в дрожжах [531—535]. У Aerobacter aerogenes тиометиладенозин, по-видимому, участвует в процессе синтеза метионина, протекающем с использованием а-аминомасляной кислоты [536]. В дрожжевых клетках метилмеркаптан используется для синтеза метионина, S-аденозилметионина и тиометиладенозина; в присутствии этилмеркаптана образуются этионин и тиоэтиладенозин [537].
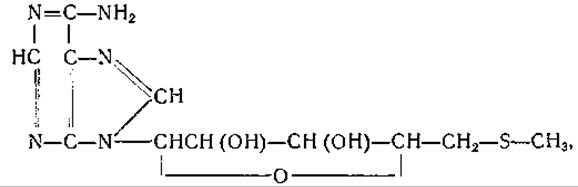
Метилметионинсульфоний и метионинсульфоксид могут поддерживать рост у крыс и у различных микроорганизмов [517, 519]. Метионинсульфоксид при этом, по-видимому, восстанавливается в метионин [538]. Что касается метилметионинсульфония, то имеются данные, указывающие на утилизацию его в результате переноса метильной группы к холину и креатину без предварительного образования метионина [539]; для обоснования этого предположения нужны дальнейшие исследования.
В работах, упомянутых выше, была показана возможность синтеза метальных групп в тканях крысы (стр. 371). Отношение витамина и фолевой кислоты к синтезу метальных групп было выявлено в опытах по питанию крыс. Некоторым мутантам Escherichia coli для роста необходим либо метионин, либо витамин B12. Как витамин B12, так и фолевая кислота уменьшают потребность в пищевом холине, необходимом для предотвращения поражения почек у крыс и развития перозиса у цыплят [501, 504]. Как упоминалось выше, метальные группы могут синтезироваться путем восстановления «формиата». Имеются данные, показывающие, что предшественниками подвижных метальных групп могут, служить метиловый спирт и формальдегид. Участие производных фолевой кислоты в переносе подвижных метальных групп и в процессе взаимопревращения серина и глицина не подвергается сомнению (стр. 327). Витамин В12, по-видимому, играет также роль в обмене одноуглеродных остатков и в синтезе метальных групп за счет а-углеродного атома глицина. Последняя реакция протекает с пониженной интенсивностью при недостаточности витамина В12, а также при недостаточности фолевой кислоты, витамина В6 или пантотеновой кислоты [539]. Доказана возможность окисления метальных групп до СO2 в целом организме [540, 581]. Так, например, после введения крысам метионина, меченного С14 в метильной группе, в выдыхаемом воздухе присутствовала С14O2.