Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Лизин
Биосинтез
Биосинтез лизина изучен у плесени Neurospora, дрожжей и бактерий. Были обнаружены два пути синтеза этой аминокислоты; в одном из них промежуточными продуктами являются некоторые соединения, которые образуются и при распаде лизина в организме высших животных.
Отправным пунктом в исследовании путей биосинтеза лизина у Neurospora явилось выделение различных мутантов этого плесневого гриба, нуждающихся для роста в лизине. Один из этих мутантов способен расти на средах, содержащих либо лизин, либо а-аминоадипиновую кислоту [1017, 1018]. Было установлено, что при культивировании этого штамма на среде с добавлением а-аминоадипиновой кислоты, меченной С14, почти весь внесенный радиоизотоп включается в лизин [1018]. Эти результаты указывают на то, что у Neurospora а-аминоадипиновая кислота служит предшественником лизина. Поскольку изотоп не был найден в других аминокислотах, а-аминоадипиновая кислота, по-видимому, не подвергается расщеплению с образованием промежуточных продуктов цикла Кребса. DL-a-аминоадипиновая кислота обеспечивает рост данного штамма плесени в такой же мере, как и эквимолярное количество L-a-аминоадипиновой кислоты. У некоторых мутантов Ophiostoma, нуждающихся в лизине, а-аминоадипиновая кислота может быть заменена а-кетоадипиновой кислотой [1019]. Заслуживает внимания, что ε-окси-а-аминокапроновая кислота поддерживает рост некоторых мутантных штаммов Neurospora [1020]. D-Лизин используется для роста некоторыми мутантами Neurospora, у которых нарушены ранние стадии биосинтеза лизина; штаммы, у которых блокировано ближайшее к лизину звено биосинтетического процесса, не могут использовать D-лизин.
1 Этот фермент правильнее называть тирозиндефенолазой. — Прим. ред.
Переход лизина в пипеколиновую кислоту обнаружен у Neurospora [1021—1023]; это превращение может происходить путем переаминирования или окислительного дезаминирования лизина по а- или ε -аминогруппе с образованием дегидропипеколиновых кислот, которые затем восстанавливаются в пипеколиновую кислоту. Мицелий Neurospora способен превращать а-кето-ε-аминокапроновую кислоту (находящуюся в равновесии с циклической формой, ∆1-пиперидин-2-карбоновой кислотой) в лизин и в пипеколиновую кислоту [1023].
Хотя имеются все основания считать а-аминоадипиновую кислоту предшественником лизина у Neurospora, промежуточные этапы этого превращения неизвестны. Данные, полученные при изучении распада лизина в других биологических объектах, заставляют думать о превращениях с участием δ-полуальдегида а-аминоадипиновой кислоты, а- или ε-ацилпроизводных лизина и аналогичных соединений. Хотя по этому вопросу имеются некоторые правдоподобные гипотезы, определенные данные об образующихся в ходе биосинтеза лизина продуктах отсутствуют. В приведенной ниже схеме (см. стр. 426) показаны некоторые возможные взаимопревращения предшественников лизина.
В последние годы получены данные, свидетельствующие об образовании у Neurospora а-окси-ε-N-ацетиламинокапроновой кислоты [1023]; однако это соединение не было однозначно идентифицировано.
Некоторые данные имеются также относительно взаимопревращений у Neurospora между лизином, а-кето-ε-аминокапроновой кислотой (∆1-пиперидин-2-карбоновая кислота), а-аминоадипиновой и пипеколиновой кислотами; однако происхождение шестиуглеродной цепи остается неизвестным. В исследованиях, проведенных при помощи радиоактивных изотопов, получены лишь первые указания на происхождение шестиуглеродного остова у Neurospora и Torulopsis [237, 1024, 1026, 1027, 1036]. Установлено, что ε-углеродный атом и углеродный атом карбоксильной группы лизина происходят из карбоксильной группы уксусной кислоты; все остальные углеродные атомы лизина имеют источником углеродные атомы метальных групп уксусной кислоты. Результаты изотопных исследований позволяют предполагать, что в процессе синтеза углеродной цепи лизина ацетат конденсируется с a-кетоглутаратом с образованием гомолимонной кислоты; последняя в результате реакций, аналогичных реакциям цикла лимонной кислоты, превращается последовательно в гомоизолимонную, щавелевоглутаровую и а-кетоадипиновую кислоты [1027, 1036].
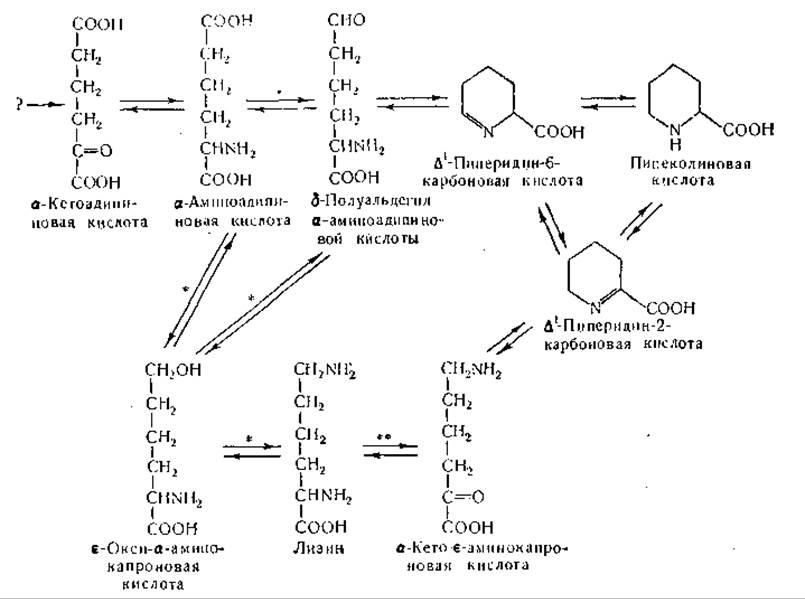
* Превращению, возможно, подвергается a-N-ацилпроизводное.
** Превращению, возможно, подвергается ε-N-ацилпроизводное.
У ряда бактерий биосинтез лизина протекает через а-ε-диаминопимелиновую кислоту. По данным Уорк и ее сотрудников, а также других авторов [1028—1033] (стр. 51), мезо- и LL- формы а, ε-диаминопимелиновой кислоты широко распространены у самых различных бактерий; у некоторых бактерий, например у грамположительных кокков, у водорослей, грибов и дрожжей эта аминокислота не найдена. Диаминопимелиновая кислота, по-видимому, является предшественником лизина; на это указывает ее превращение в лизин под действием специфической декарбоксилазы (стр. 209). Это предположение подтверждается также данными Дэвиса [1034], выделившего мутантный штамм Escherichia coli, который проявляет абсолютную потребность в а, ε-диаминопимелиновой кислоте и относительную — в лизине как факторах роста. Было найдено, что у некоторых мутантных штаммов Е. coli, для роста которых обязательно присутствие лизина, утрачена декарбоксилаза диаминопимелиновой кислоты; последняя накапливается в культурах этих мутантов. Однако мутантные штаммы, способные к росту на диаминопимелиновой кислоте, содержат декарбоксилазу. Диаминопимелиновая кислота, по-видимому, с трудом поглощается клетками микроорганизмов из внешней среды; этим можно объяснить тот факт, что для оптимального роста некоторых мутантных штаммов необходима как диаминопимелиновая кислота, так и лизин. Эти исследования были проведены до того, как были синтезированы и изучены три изомера диаминопимелиновой кислоты; возможно, что значение изложенных выше фактов станет более ясным после повторения опытов с применением чистых изомеров диаминопимелиновой кислоты. После получения синтетических изомеров диаминопимелиновой кислоты было установлено, что у микроорганизмов встречаются мезо- и LL-формы этой аминокислоты; субстратом декарбоксилазы диаминопимелиновой кислоты является мезо-форма. Образованию лизина из LL-a, ε-диаминопимелиновой кислоты должно предшествовать ее превращение в мезо-форму, что осуществляется специфическим ферментом, радемазой диаминопимелиновой кислоты (стр. 244).
Пути биосинтеза диаминопимелиновой кислоты неизвестны; однако данные, полученные на мутантных штаммах, а также в исследованиях, проведенных с применением изотопов, позволяют предполагать, что предшественником диаминопимелиновой кислоты может служить аспарагиновая кислота (но не треонин или гомосерин) [117, 1034, 1035, 1141]. Возможно, что у Escherihia coli гомосерин и лизин имеют общего предшественника, который образуется из аспарагиновой кислоты (стр. 333).
а, ε-Диаминопимелиновая кислота (или, возможно, продукты ее распада) может превращаться в дипиколиновую кислоту (стр. 58) [1037].