Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Окислительное дезаминирование
Дегидрогеназа L-глутаминовой кислоты
Обратимое дезаминирование глутаминовой кислоты имеет первостепенное значение в обмене веществ. У млекопитающих и у многих других видов эта реакция служит одним из главных механизмов взаимопревращения азота а-аминогруппы и аммиака. Дегидрогеназа глутаминовой кислоты распространена очень широко: она найдена у растений [155—157], у животных [158, 159] и у микроорганизмов [155, 160, 161]. Фермент обнаружен почти во всех тканях млекопитающих; в тканях печени и почек он наиболее активен. Дегидрирование глутаминовой кислоты можно представить следующим образом:
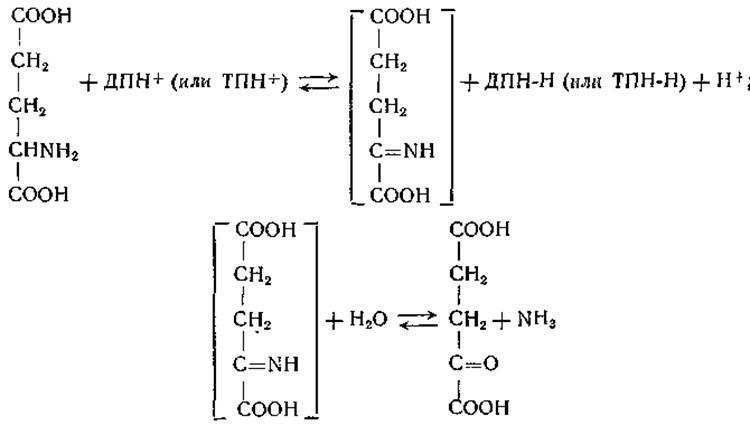
Эта реакция подобна реакциям, катализируемым общими аминокислотными оксидазами; предполагают, что в качестве промежуточного продукта образуется иминокислота. В действии глутаматдегидрогеназы высших растений и большинства животных тканей участвует в качестве кофермента дифосфопиридиннуклеотид (ДПН). Фермент, присутствующий в печени, действует при участии как ди-, так и трифосфопиридиннуклеотида (ТПН), однако реакция с участием ТПН при определенных условиях протекает с меньшей скоростью [162]. Так, например, скорость окисления восстановленного трифосфопиридиннуклеотида в ткани может ограничиваться недостатком ТПН-цитохромредуктазы [163]. Глутаматдегидрогеназы из дрожжей и Escherichia coli строго специфичны в отношении ТПН [160, 161].
Глутаматдегидрогеназа бычьей печени получена в кристаллическом виде двумя методами [164, 165]. Фермент содержит цинк [166]. Положение равновесия реакции благоприятствует образованию глутаминовой кислоты, и при надлежащих условиях фермент можно использовать для приготовления N15-глутаминовой кислоты из а-кетоглутарата и меченого аммония.
Глутаматдегидрогенеза строго специфична в отношении L-глутаминовой кислоты; глутамин, аспарагиновая кислота, а-метилглутаминовая и y-метилглутаминовая кислоты и другие производные глутаминовой кислоты не дегидрируются этим ферментом.