Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Декарбоксилирование аминокислот
Аминокислотные декарбоксилазы млекопитающих
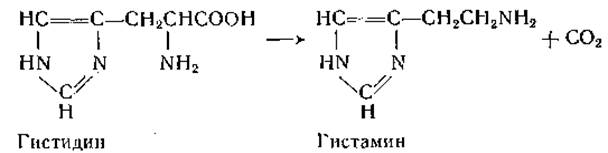
Некоторые L-аминокислоты, в том числе гистидин, цистеиновая кислота, цистеинсульфиновая кислота, 3,4-диоксифенилаланин, глутаминовая кислота и 5-окситриптофан, декарбоксилируются ферментами, обнаруженными в тканях млекопитающих. Реакции декарбоксилирования в общем не играют в количественном отношении существенной роли в превращении аминокислот в организме животных; вместе с тем некоторые реакции декарбоксилирования, например те, которые ведут к образованию серотонина и гистамина, имеют большое биологическое значение. У млекопитающих первая аминокислотная декарбоксилаза была открыта в 1936 г. Верле, который обнаружил, что при инкубировании гистидина с ферментными препаратами из почек кролика образуется вещество, обладающее физиологическими свойствами гистамина [200]. Фермент, в дальнейшем полученный в очищенном виде, катализирует следующую реакцию [201, 202]:
Ферментные препараты почек декарбоксилируют также 3,4-диоксифенилаланин (ДОФА) с образованием 3,4-диоксифенилэтиламина [203—205]. Этот амин был идентифицирован в виде бензоильного производного.
Получены стабильные препараты ДОФА-декарбоксилазы; ее коферментом является пиридоксальфосфат [206—208]. Препараты ДОФА-декарбоксилазы декарбоксилируют и некоторые другие производные фенилаланина [209]. Тирозин, по-видимому, не декарбоксилируется ферментными препаратами из тканей млекопитающих [209]. В ранних работах приводились данные о декарбоксилировании тирозина с образованием тирамина [203—205], однако в печати больше не появлялось сообщений, подтверждающих наличие этой реакции.
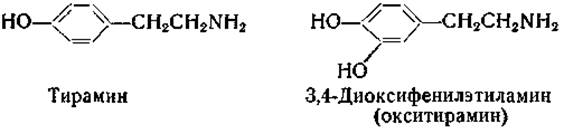
Было описано также декарбоксилирование триптофана ферментными препаратами из почек с образованием амина, обладающего прессорным действием [205], но в последнее время Юденфренд и его сотрудники [210, 211] установили, что триптофан сперва окисляется в 5-окситриптофан, который и является субстратом специфической декарбоксилазы, катализирующей следующую реакцию:
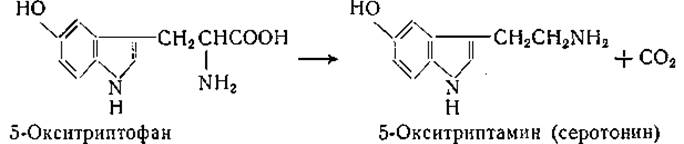
5-Окситриптамин (серотонин) известен как физиологически активное вещество, оказывающее прессорное действие (стр. 406). Декарбоксилаза 5-окситриптофана обнаружена во многих тканях животных; в очищенном состоянии фермент получен из почек свиньи и морской свинки.
Опубликованы данные, согласно которым препараты из печени и почек кролика и морской свинки, а также из надпочечников коровы декарбоксилируют n-оксифенилсерин; ДОФА-декарбоксилаза на этот субстрат не действует. Предполагаемый продукт декарбоксилировании n-оксифенилсерина — n-оксифенилэтаноламин — не был точно идентифицирован [196].
В печени многих животных, в том числе морской свинки, крысы и собаки, происходит декарбоксилирование цистеиновой кислоты с образованием таурина [198, 212, 213]. В печени кролика и кошки декарбоксилаза цистеиновой кислоты, по-видимому, отсутствует. Как указано ниже (стр. 382), декарбоксилирование цистеиновой кислоты, вероятно, представляет лишь один из нескольких возможных механизмов образования таурина. Последний может образоваться, например, путем двустороннего декарбоксилировании цистиндисульфоксида или из цистаминдисульфоксида. Более вероятно, что таурин образуется путем окисления 2-аминоэтансульфиновой кислоты (гипотаурина). Гипотаурин был обнаружен и идентифицирован в печени и моче крыс, которым скармливали цистеин; доказано, что этот амин образуется путем ферментативного декарбоксилирования цистеинсульфиновой кислоты (стр. 382).
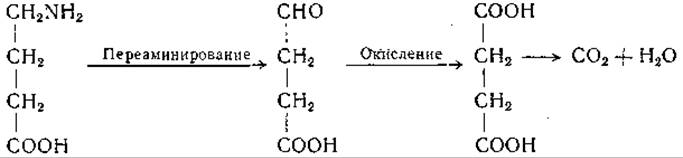
Вслед за открытием y-аминомасляной кислоты в ткани мозга в этом органе была обнаружена декарбоксилаза глутаминовой кислоты [214, 215]. Некоторые другие ткани также проявляют слабую глутаматдекарбоксилазную активность, однако в основном образование y-аминомасляной кислоты происходит в мозге. Значение этой аминокислоты и пути ее превращения в организме окончательно не выяснены. Известно, однако, что y-аминомасляная кислота вступает в реакцию переаминирования с а-кетоглутаровой кислотой, причем образуются глутаминовая кислота и полуальдегид янтарной кислоты (стр. 227). Поэтому есть основание думать, что обмен этой аминокислоты может протекать путем ее окисления в цикле лимонной кислоты через янтарную кислоту:
Как правило, декарбоксилазы млекопитающих имеют pH-оптимум в нейтральной или слабощелочной зоне. Высокоочищенные препараты аминокислотных декарбоксилаз получить до сих пор не удалось; однако установлено, что для большинства из них в качестве кофермента необходим пиридоксальфосфат (табл. 20).
Вполне вероятно, что в тканях млекопитающих существуют и другие аминокислотные декарбоксилазы. Известно, что серин может превращаться в этих тканях в этаноламин; однако до сих пор эту реакцию декарбоксилирования непосредственно наблюдать не удалось. У бактерий аналогичная реакция обнаружена [216]. Недавно появились сообщения о декарбоксилировании аминомалоновой кислоты препаратами из шелкоотделительной железы шелковичного червя и из печени крыс [703]:
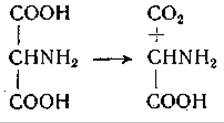
Таблица 20 Ферментативное декарбоксилирование аминокислот
|
Аминокислота |
Продукт декарбоксилирования |
Источник фермента |
|
L-Аргинин * |
Агматин |
Бактерии |
|
L-Аспарагиновая кислота |
ß-Аланин |
» |
|
L-Аспарагиновая кислота * |
L-Аланин |
» |
|
L-Цистеиновая кислота * |
Таурин |
Ткани млекопитающих |
|
L-Цистеинсульфиновая кислота * |
Гипотаурин |
» » |
|
мезо-а, ε-Диаминопимелиновая кислота* |
L-Лизин |
Бактерии |
|
3, 4-Диокси-L-фенилаланин * |
3, 4-Диоксифенилэтиламин |
Бактерии, ткани млекопитающих |
|
L-Глутаминовая кислота * |
у-Аминомасляная кислота |
Бактерии, ткани млекопитающих, растительные ткани |
|
L-Гистидин* |
Гистамин |
Бактерии, ткани млекопитающих |
|
алло-β-Оксиглутаминовая кислота ** |
у-Амино-β-оксимасляная кислота |
Бактерии |
|
у-Оксиглутаминовая кислота |
а-Окси-у-аминомасляная кислота |
|
|
5-Окси-L-лизин |
(Оксикадаверин) **** |
|
|
n-Оксифенилсерин *** |
(n-Оксифенилэтаноламин) **** |
Ткани млекопитающих |
|
5-Окси-L-триптофан * |
5-Окситриптамин |
» » |
|
L-Лизин * |
Кадаверин |
Бактерии |
|
у-Метилен-L-глутаминовая кислота |
у-Амино-а-метиленмасляная кислота |
Растительные ткани |
|
L-Орнитин * |
Путресцин |
Бактерии |
|
L-Фенилаланин * |
Фенилэтиламин |
» |
|
L-Тирозин * |
Тирамин |
» |
* Реакция активируется пиридоксальфосфатом.
** Реакция активируется пиридоксальфосфатом; исследования проведены на рацемической форме аминокислоты.
*** Исследования проведены на смеси изомеров аминокислот.
**** Продукт реакции не идентифицирован.