Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Перреаминирование
Общие замечания
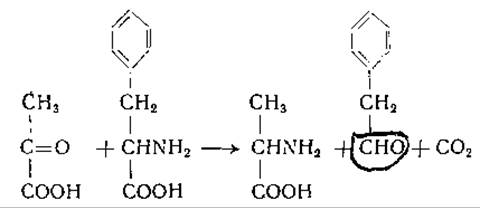
Переаминированием, или трансаминированием, называют химическую реакцию, при которой происходит перенос аминной группы от одной молекулы к другой без промежуточного образования аммиака. Реакции такого типа впервые были обнаружены в 1934 г. Хербстом и Энгелем [249, 250], наблюдавшими перенос а-аминогрупп аминокислот на а-кетокислоты в кипящем водном растворе. Продуктами реакции между пировиноградной кислотой и фенилаланином были аланин, фенилуксусный альдегид и СО2:
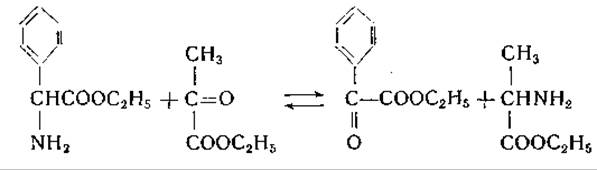
При использовании эфиров амино- и кетокислот наблюдаются реакции следующего типа:
Ферментативное переаминирование было открыто в 1937 г. Браунштейном и Крицман [251], которые наблюдали перенос аминогрупп от а-аминокислот к а-кетокислотам в кашице из грудной мышцы голубя. Этому открытию предшествовали отдельные наблюдения, относящиеся к данному процессу. Нейбауер [110] и Кнооп [111] в начале XX века наблюдали переход аминокислоты в соответствующую кетокислоту и обратное превращение в опытах на животных in vivo и на дрожжевых клетках. Д. Нидхэм. [252] в 1930 г. обнаружила, что в грудной мышце голубя может происходить дезаминирование глутаминовой и аспарагиновой кислот без выделения аммиака; другие авторы отмечали, что в грудной мышце голубя скорость исчезновения щавелевоуксусной кислоты повышается при добавлении глутаминовой кислоты [253, 254].
Согласно первоначальным данным Браунштейна и Крицман, кетоглутаровая и щавелевоуксусная кислоты могут служить акцепторами a-аминогрупп многих аминокислот. Коэн в своих исследованиях указал на несовершенство использованных в первоначальных работах аналитических приемов. В результате дальнейших исследований Коэна [255, 256] первоначальные представления были пересмотрены и сложилось мнение, что существенную роль в процессах переаминирования играют только три аминокислоты (см. также у Браунштейна [257]):
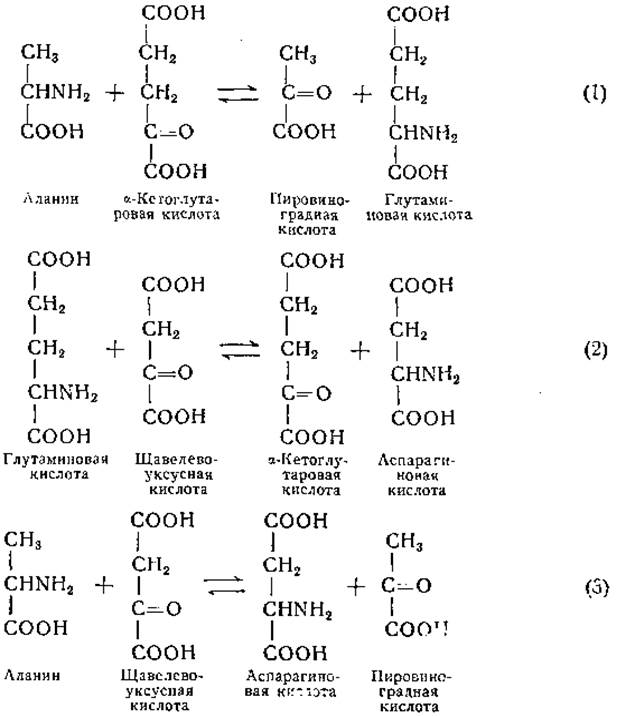
Данные более поздних исследовании свидетельствуют о том, что реакция (3), по крайней мере в сердечной мышце, представляет собой сумму реакций (1) и (2) и не катализируется особым ферментом [258].
Хотя результаты проведенных ранее работ [255, 257, 260] давали основание предполагать, что в реакциях переаминирования участвуют и другие аминокислоты, помимо трех названных выше, еще недавно господствовало представление об относительно малом значении таких реакций в процессах обмена веществ. Ввиду этого многие наблюдения, касающиеся обратимого аминирования аминокислот, не находили объяснения. Шёнхаймер, важные исследования которого по вопросам обмена аминокислот и динамического состояния белков в организме уже упоминались (стр. 177), писал в 1941 г.: «Участие в ... [в реакциях переаминирования] установлено только для глутаминовой кислоты, аспарагиновой кислоты и аланина в отличие от всех других аминокислот. Обнаруженное в наших опытах появление изотопа в других аминокислотах белков крысы нельзя приписать ни действию фермента Эйлера, ни действию [ферментной системы, описанной] Браунштейном. Необходимо исследовать другие механизмы».
Другие относительно давние наблюдения также указывали на большое значение реакции переаминирования в обмене веществ. Было найдено, что а-кетокислота, соответствующая тироксину, обладает физиологическим действием, характерным для тироксина, и в 1935 г. были получены данные, дающие основание отнести физиологическую активность этой кетокислота за счет ее аминирования с образованием тироксина [261]. В опытах по перфузии изолированных органов и in vivo на интактных животных было установлено превращение ряда а-кетокислот (помимо пировиноградной, щавелевоуксусной и а-кетоглутаровой) в соответствующие аминокислоты. В связи с этим представляют интерес данные опытов, в которых удавалось обеспечить рост крыс и размножение микроорганизмов при полной замене некоторых аминокислот пищи соответствующими а-кетокислотами (стр. 137).
В 1950 г. в результате независимых исследований нескольких групп авторов было установлено, что диапазон специфичности реакций ферментативного переаминирования чрезвычайно широк [277, 279, 282]. Эти работы и данные, опубликованные позднее, свидетельствуют о том, что едва ли не все природные аминокислоты доступны ферментативному переаминированию.
Термин «переаминирование» («трансаминирование»), обозначающий процесс переноса аминных групп, стал общепринятым; ферменты, катализирующие эти реакции, обозначаются либо как «трансаминазы», либо как «аминоферазы». Последний термин был предложен русскими авторами [257], которые наряду с другими авторами придерживаются его и в настоящее время. Термин «трансаминазы», предложенный Коэном, получил более широкое распространение; этот термин применяется и в настоящей монографии.
Номенклатура трансаминаз осложняется тем, что эти ферменты катализируют обратимые реакции, в которых участвует не менее четырех субстратов (а иногда и больше). В этой книге реакции переаминирования обозначены наименованиями реагирующих веществ, соединенными дефисом, например реакции глутамат-пируват. Для обозначения обратимых реакций можно пользоваться наименованиями исходной и конечной аминокислот, опуская участвующие в реакции кетокислоти (например, реакция глутамат-аланин).
В названиях трансаминаз, катализирующих обратимые реакции, также указываются обе аминокислоты, являющиеся субстратами, например глутамат-аланин-трансаминаза. Если в реакцию могут вступать не две, а несколько аминокислот, то применяются такие обозначения, как глутамат-валин, лейцин, изолейцин-трансаминаза. Но если фермент катализирует реакции между любой из аминокислот, входящих в группу субстратов, и аналогичными a-кетокислотами, то наименования всех субстратов следует соединять дефисами, например глутамат-валин-лейцин-изолейцин-трансаминаза. Эта номенклатура в данное время представляется удобной; после того как трансаминазы будут получены в высокоочищенном состоянии, возможно, окажется желательным и даже необходимым пересмотреть терминологию.
1 Высокоочищенные препараты глутамат-аспартат-трансаминазы из сердечной мышцы свиньи получили в 1957 г. Дженкинс и Сайзер, детально изучившие свойства этого фермента [J. Am. Chem. Soc., 79, 2655 (1957); J. Biol. Chem., 234, 51, 1179 (1959)]. В частности, ими доказано взаимопревращение альдегидной и аминной формы простегической группы этой трансаминазы при взаимодействии с соответствующими субстратами (спектрофотометрические исследования и препаративное выделение пиридоксальфосфата и пиридоксаминфосфата после отщепления их от апофермента). — Прим. ред.