Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Перреаминирование
Реакции между a-кетоглутаровой кислотой и аминокислотами
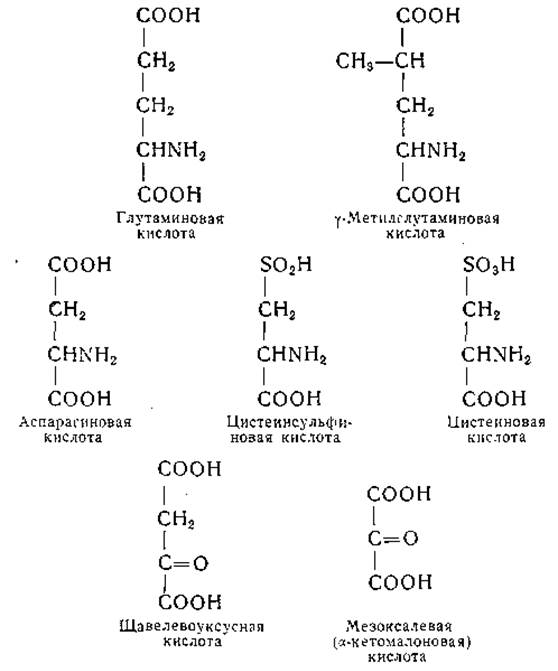
Препараты из самых разнообразных биологических объектов осуществляют обратимые реакции переаминирования между a-кетоглутаровой кислотой и аланином и между а-кетоглутаровой и аспарагиновой кислотами. Что эти две реакции катализируются отдельными ферментами, было доказано путем их разделения и частичной очистки; оба фермента были выделены из сердечной мышцы свиньи. На разработку способов очистки глутамат-аспартат-трансаминазы [208, 262—264] и глутамат-аланин-трансаминазы [208, 265] затрачено много усилий, но до недавнего времени эти ферменты не были получены в виде гомогенных препаратов К Глутамат-аспартат-трансаминаза сердца свиньи проявляет активность по отношению к мезоксалевой кислоте (вместо щавелевоуксусной кислоты) и к цистеиновой кислоте (вместо аспарагиновой кислоты); однако с этими субстратами скорость реакции значительно понижена. Вместе с тем реакция переаминирования между цистеинсульфиновой кислотой и a-кетоглутаратом протекает в присутствии очищенных препаратов глутамат-аспартат-трансаминазы со значительно большей скоростью, чем реакция между аспарагиновой и а-кетоглутаровой кислотами [266, 267]. Глутамат-аспартат-трансаминаза сердца свиньи осуществляет также реакцию переаминирования между у-метилглутаминовой (но не ß-метилглутаминовой) и щавелевоуксусной кислотами примерно с такой же скоростью, как реакцию между глутаминовой и щавелевоуксусной кислотами [268]. По-видимому, эти реакции катализирует один и тот же фермент. О сходстве между молекулами упомянутых выше субстратов позволяют судить их структурные формулы:
Очищенные препараты глутамат-аланин-трансаминазы сердца свиньи проявляют некоторую активность при замене пировиноградной кислоты а-кетомасляной или мезоксалевой кислотой [208, 269]; однако этот фермент не катализирует реакций переаминирования с участием у-метилглутаминовой или ß-метилглутаминовой кислоты [268].
Таблица 21 Реакция переаминирования между а-кетоглутаровой кислотой и аминокислотами
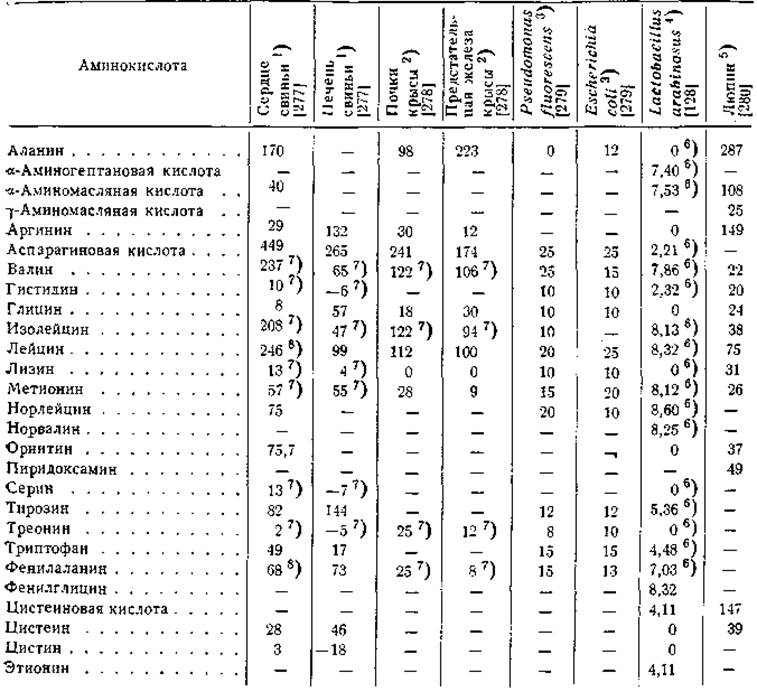
1) Число микролитров СО2, выделяемой глутаматдекарбоксилазой из образовавшейся глутаминовой кислоты.
2) Число микромолей образовавшейся глутаминовой кислоты по данным колориметрических определений.
3) Число микромолей образовавшейся глутаминовой кислоты по данным хроматографии на бумаге с визуальным сопоставлением исследуемых и стандартных пятен; конфигурации аминокислот не указаны.
4) Число микромолей глутамата, найденных при определении при помощи L-глутаматдекарбоксилазы.
5) Активность пятна глутаминовой кислоты на хроматограмме (число импульсов С14 в 1 мин.). Препарат цитоплазматических гранул люпина инкубировали с аминокислотой и С14-а-кетоглутаратом; конфигурация аминокислот не указана. Число импульсов в контроле (без добавления аминокислоты) равнялось 16.
6) D-Изомер не активен.
7) Аминокислота в виде рацемата.
8) Величины для D-лейцина и D-фенилаланина равны соответственно 9 и 7 мл [277].
Таблица 22 Реакции переаминирования, описанные в литературе*



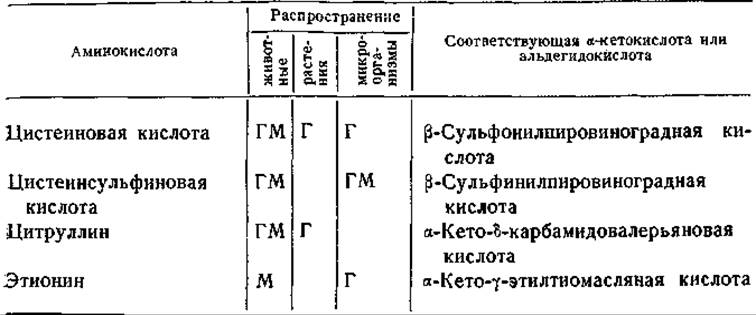
* Г — реакции, протекающие с участием L-глутаминовой или а-кетоглутаровой кислот; М — реакции, протекающие с участием монокарбоновых а-амино- или а-кетокислот. Все аминокислоты L-конфигурации, за исключением особо указанных; у ряда микроорганизмов в реакцию переаминирования может вступать и D-изомер некоторых аминокислот (указано в скобках).
Вопрос о существовании особой аспартат-аланин-трансаминазы еще не решен. В сердечной мышце свиньи реакция между aспартатом и аланином, по-видимому, представляет собой результат сопряжения реакций между аланином и глутаминовой кислотой, с одной стороны, и глутаминовой и аспарагиновой кислотами — с другой [258]. Было описано выделение аспартат-аланин-трансаминазы из печени голубя [270], но эти наблюдения не были подтверждены в другой лаборатории [271]. В том, что многие препараты из животных и растительных тканей, а также микроорганизмы способны осуществлять реакцию переаминирования между аспарагиновой кислотой и аланином, нет никаких сомнений. Однако почти во всех этих препаратах присутствуют также глутамат-аланин- и глутамат-аспартат-трансаминазы. Вполне возможно существование единой глутамат-аспартат-аланин-трансаминазы, т. е. фермента, катализирующего реакции между любой из этих трех аминокислот и каждой из соответствующих а-кетокислот. Ферментные системы такого рода обнаружены у Escherichia coli [272] и Neurospora crassa [273].
Обратимые реакции переаминирования между многими аминокислотами и а-кетоглутаровой кислотой были осуществлены в опытах с ферментными препаратами из тканей животных и растений и из микроорганизмов. Еще в ранних исследованиях приводились данные о реакциях переаминирования с участием валина [256], а-аминоадипиновой кислоты [257, 274], а-аминомалоновой кислоты [257, 274], цистеиновой [257, 274] и гомоцистеиновой кислот [257, 274], лейцина [275, 276] и изолейцина [275]. Однако эти реакции, как правило, отличались малой интенсивностью по сравнению с реакциями переаминирования глутаминовой и аспарагиновой кислот и аланина. В более поздних работах, проведенных с использованием более совершенных методов идентификации и количественного определения аминокислот и с применением очищенных препаратов ферментов, доказано существование реакций переаминирования между а-кетоглутаратом и самыми разнообразными аминокислотами. Некоторые описанные в литературе реакции этого рода приведены в табл. 21, а сводный перечень субстратов, участвующих в реакциях ферментативного переаминирования, дан в табл. 22.