Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Перреаминирование
Реакции переаминирования между амидами аминокислот и а-кетокислотами
Первоначально сложилось убеждение, что глутамин и аспарагин могут участвовать в реакциях переаминирования лишь после предварительного дезамидирования с образованием соответствующих дикарбоновых аминокислот [257, 281]. Не вызывает сомнений, что распад глутамина и аспарагина в организме может начинаться с дезамидирования, после чего образующиеся аспарагиновая и глутаминовая кислоты подвергаются тем или иным дальнейшим превращениям, включая и реакции переаминирования, однако получены данные, свидетельствующие о том, что глутамин и аспарагин могут как таковые непосредственно вступать в реакции переаминирования. Ферменты, катализирующие такие реакции, найдены в печени и почках млекопитающих. Переаминирование глутамина впервые было обнаружено в опытах с ферментами из печени крысы, которые катализируют следующую реакцию [282]:
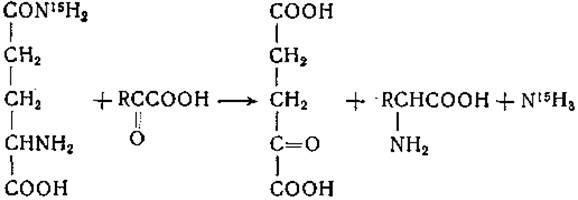
Переаминирование глутамина сопровождается реакцией дезамидирования; опыты с применением глутамина, меченного N15 по амидной группе, показали, что аммиак образуется из амидной группы глутамина. В отсутствие а-кетокислоты образование аммиака не имело места; при замене глутамина глутаминовой кислотой скорость реакции переаминирования с различными а-кетокислотами значительно снижалась или реакция не происходила вовсе [283]. При замене глутамина у-метилглутамином или у-метиленглутамином переаминирование происходит, но в отличие от реакции с глутамином аммиак в этом случае не образуется. Эти данные указывают на следующие этапы в ферментативной реакции между глутамином и а-кетокислотой [284, 285]:
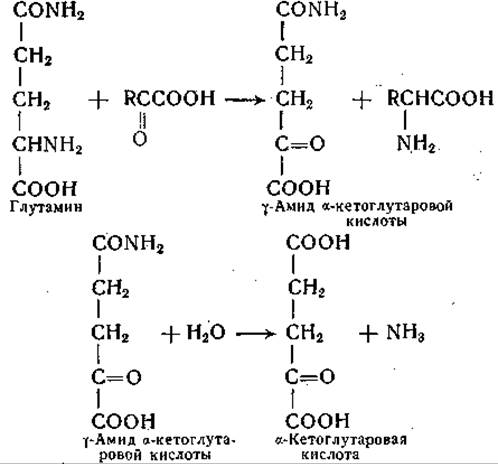
Такой порядок реакций подтверждают данные, полученные при изучении аналогичной реакции между y-метилглутамином и а-кетокислотами, протекающей следующим образом:
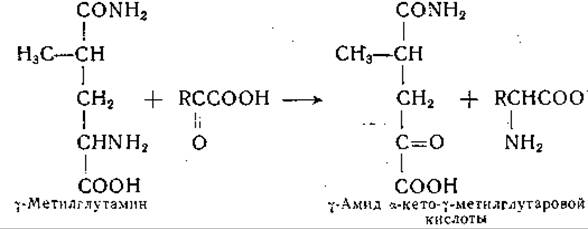
Образование y-амида а-кето-y-метилглутаровой кислоты доказано; установлено, что эта a-кетокислота не гидролизуется ферментными препаратами из печени. Предполагаемый промежуточный продукт, образующийся при переаминировании глутамина с а-кетокислотами, — y-амид а-кетоглутаровой кислоты — был синтезирован; оказалось, что этот амид гидролизуется с образованием а-кетоглутаровой кислоты и аммиака ферментными препаратами, катализирующими реакцию сочетанного переаминирования и дезамидирования глутамина, а также препаратами из ряда других тканей [286]. Фермент, катализирующий дезамидирование y-амида а-кетоглутаровой кислоты, был получен из печени крысы в очищенном виде и отделен от трансаминазы [287]. Трансаминаза глутамина проявляет активность в реакциях с участием многочисленных а-кетокислот, в том числе а-кетокислотных аналогов аланина, глицина, серина, а-аминомасляной кислоты, норвалина, норлейцина, лейцина, фенилаланина, тирозина, метионина, глутаминовой кислоты, триптофана, аспарагина, цистеина, аргинина и цистеиновой кислоты [127, 283, 285, 288—290]. Этот фермент может, кроме того, аминировать за счет глутамина такие а-кетокислоты, которые соответствуют аминокислотам, неспособным заменять глутамин как донатор аминогруппы, например аспарагину, y-диметиламиду глутаминовой кислоты, S-амиду и S-метиламиду а-аминоадипиновой кислоты. Помимо этого, удалось осуществить реакции переаминирования между глутамином и N-ß-оксалацетилпроизводными глицина и аланина с образованием соответствующих ß-аспартилпептидов — ß-аспартилглицина и ß-аспартилаланина [154].
В опытах с ферментными препаратами из печени была обнаружена также аналогичная реакция сочетанного переаминирования и дезамидирования аспарагина, причем установлено, что трансаминаза аспарагина не идентична трансаминазе глутамина [289]. Последовательность реакций оказалась той же, что и в системе трансаминазы глутамина. Поскольку сродство ω-амидазы к ß-амиду а-кетоянтарной кислоты невелико, удается наблюдать реакцию переаминирования, идущую в обратном направлении, а именно — образование аспарагина из ß-амида а-кетоянтарной кислоты и различных L-аминокислот [290]:
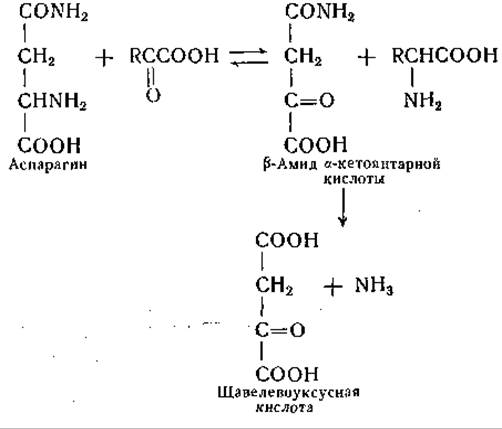
Эта реакция могла бы играть роль не только при распаде аспарагина, но и в процессе его биосинтеза; однако до сих пор не известно других путей образования ß-амида а-кетоянтаркой кислоты, кроме переаминирования или окислительного дезаминирования самого аспарагина.
Заслуживает внимания, что в реакциях как неферментативного [291], так и ферментативного переаминирования с глиоксиловой кислотой [289, 292] глутамин и аспарагин более активны, чем глутаминовая и аспарагиновая кислоты. При неферментативном переаминировании между аспарагином и пиридоксалем образуется ß-амид а-кетоянтарной (щавелевоуксусной) кислоты [290]. Аминирование фенилпировиноградной и n-оксифенилпировиноградной кислот ферментными препаратами из почек теленка также протекает значительно быстрее за счет глутамина или аспарагина, чем за счет соответствующих дикарбоновых аминокислот [293]. В исследованиях, выполненных в последние годы, реакции переаминирования между глутамином и а-кетокислотами обнаружены у некоторых растений [294] и у насекомых [704].