Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Рацемизация аминокислот
Рацемаза а,ε-диаминопимелиновой кислоты
Вскоре после открытия в клетках ряда бактерий мезо-а,ε-диаминопимелиновой кислоты [379—381] и LL-a, ε-диаминопимелиновой кислоты [382] в некоторых из них была обнаружена бактериальная декарбоксилаза, превращающая мезоформу диаминопимелиновой кислоты в L-лизин и углекислоту [240]. Сперва было отмечено, что LL-a,ε-диаминопимелиновая кислота доступна декарбоксилированию. Однако в дальнейшем оказалось, что кажущееся декарбоксилирование LL-изомера обусловлено превращением этого изомера в мезо-форму, представляющую истинный субстрат специфической декарбоксилазы. Фермент, осуществляющий взаимопревращение мезо- и LL-форм а,ε-диаминопимелиновой кислоты, был выделен из клеток мутантного штамма Escherichia coli, для роста которого необходим лизин. Фермент интересен в том отношении, чт,о он катализирует реакцию рацемизации одного асимметрического центра в молекуле аминокислоты, имеющей два центра асимметрии:
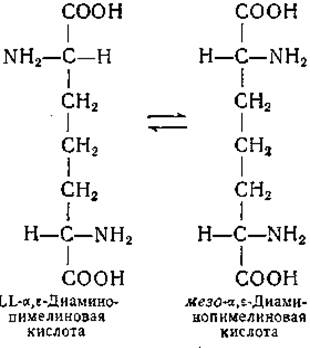
DD-изомер не рацемизуется этим ферментом. Изучение данной ферментной системы не завершено; в частности, до сих пор не установлено, участвует ли в этой реакции пиридоксальфосфат. Фермент инактивируется при диализе; тиоловые соединения восстанавливают активность диализованных препаратов.