Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Синтез пептидных связей
Реакции, катализируемые гидролитическими ферментами
При рассмотрении процессов, связанных с синтезом белка, прежде всего следует указать, что мы располагаем значительным запасом сведений о расщеплении белков на менее крупные пептиды и на свободные аминокислоты. Выделены и изучены различные протеазы, число которых очень велико. В результате исследований Бергмана и Фрутона [461—463], проведенных на синтетических пептидах, выявлены различия между двумя типами ферментов — экзопептидазами, активность которых проявляется лишь при наличии в молекуле субстрата одной или нескольких концевых групп, и эндопептидазами, расщепляющими пептидные связи, расположенные (часто во внутренних участках белковой молекулы) по соседству с определенными группами боковых цепей аминокислот.
Детально изучены протеолитические ферменты желудочнокишечного тракта животных; главными эндопептидазами этой группы являются пепсин, трипсин и химотрипсин. В желудочнокишечном тракте присутствуют также экзопептидазы, например карбоксипептидазы и аминопептидазы. В тканях животных имеются внутриклеточные протеолитические ферменты (катепсины), сходные по свойствам с протеолитическими ферментами пищеварительного тракта. Протеолитические ферменты найдены и в растениях; среди них заслуживают внимания папаин из плодов дынного дерева Carica papaya, бромелин из ананаса и фицин из млечного сока инжира. Микроорганизмы также обладают протеолитическими системами, но они в общем изучены менее детально, чем протеазы высших растений и животных. Следует отметить, что ферментные системы, расщепляющие пептиды и белки, распространены в природе очень широко. Многие протеолитические ферменты получены в кристаллическом виде и тщательно изучены в отношении специфичности, кинетики и механизма их действия. Эти вопросы детально освещены в обобщающих работах Бергмана и Фрутона [461], Нортропа и его сотрудников [464], Нейрата и Шверта [465], Фрутона и Бергмана [463], Смита [466, 467], Грина и Нейрата [468].
Физиологическая роль протеолитических систем желудочнокишечного тракта ясна; с помощью этих ферментов принятые с пищей белки подвергаются гидролизу, в основном, вероятно, до составляющих их аминокислот. Протеолитические ферменты некоторых микроорганизмов обеспечивают способность последних к инвазии животной ткани. Такова, например, функция коллагеназы у некоторых спороносных анаэробов (Clostridia). Установлено, что превращение фибриногена в фибрин в крови млекопитающих катализируется протеолитическим ферментом, отщепляющим от фибриногена пептид (стр. 79). Внутриклеточные протеолитические системы, вероятно, катализируют распад белков в клетке. Ряд исследований посвящен вопросу о возможном участии этих ферментов также и в синтезе пептидных связей; реакции, представляющие обращение гидролиза таких связей, осуществлены при помощи различных ферментных препаратов.
Гидролиз пептидной связи протеолитическими ферментными системами доходит обычно почти до конца. Поэтому значения констант равновесия этих реакций велики, и связанные с реакцией изменения свободной энергии отрицательны. Расчет изменений свободной энергии при образовании некоторых пептидов (табл. 25) показывает, что при той концентрации свободных аминокислот, какая существует в большинстве тканей (вероятно, менее 0,01 М), синтез пептидных связей путем обращения гидролиза возможен лишь в крайне незначительном масштабе [469— 471]. Синтезу пептидных связей в таких системах могли бы, однако, способствовать а) более высокие начальные концентрации аминокислот и б) удаление из системы вновь образующихся пептидов.
Таблица 25 Свободная энергия и показатели равновесия синтеза некоторых олигопептидов [469]
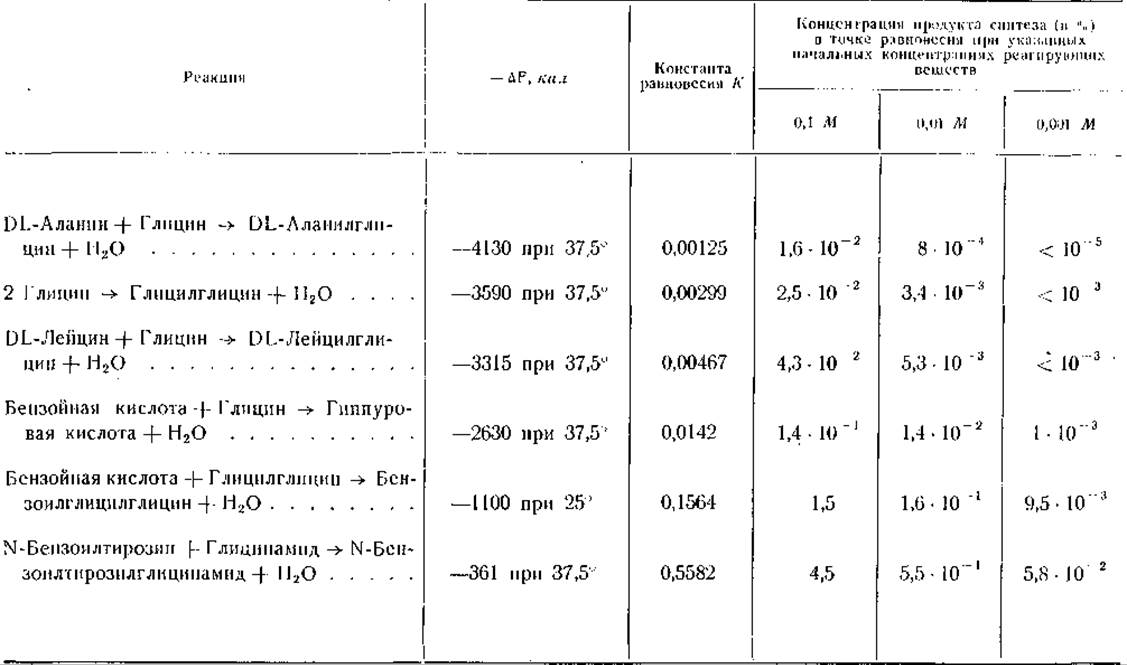
Изменение свободной энергии, связанное с образованием глицилглицина из глицина, составляет примерно 4000 кал/моль. Аналогичные величины получены для реакций образования DL-аланилглицина и DL-лейцилглицина. Изменение свободной энергии при образовании гиппуровой кислоты меньше, чем при образовании дипептидов глицина. Образование же тетрапептида триглицилглицина из глицилглицина требует вдвое меньше энергии, чем образование глицилглицина из глицина [472]. Эти данные позволяют сделать вывод об уменьшении изменений свободной энергии по мере увеличения расстояния между группами, несущими электрический заряд. Далее, образование бензоилглицина из бензоата и глицина требует меньшей затраты энергии, чем образование глицилглицина из двух молекул глицина; при образовании бензоилглицилглицина из бензоата и глицилглицина затрата свободной энергии еще меньше. Наконец, в тех случаях, когда ни одно из реагирующих соединений не является амфотерным ионом, например при образовании N-бензоилтирозилглицинамида, изменение свободной энергии совсем мало. Однако на свободную энергию образования пептидов может влиять и сама природа аминокислотных остатков (см. значения —∆F для DL-лейцилглицина и DL-аланилглицина в табл. 25). Эти соображения привели к предположению, что при образовании небольших пептидов из аминокислот затрата свободной энергии больше, чем при дальнейшей конденсации этих пептидов с образованием более крупных молекул.
Образование пептидных связей, катализируемое гидролитическими ферментами, наблюдали в таких системах, где продукт реакции нерастворим и, тем самым, удаляется из сферы реакции. Например, при приведенной ниже реакции, катализируемой химотрипсином, бензоил-L-тирозилглицинанилид выпадает в осадок и может быть получен с довольно значительным выходом:
Глицинанилид + Бензоил-L-тирозин ⇄ Бензоил- L-тирози лглицинанилид+ Н2O.
Описан ряд аналогичных реакций [473—477]. К ним относится, например, образование пластеинов [478—482] — нерастворимых высокомолекулярных пептидов с молекулярным весом 2000—400 000. Пластеины образуются в известных условиях при действии некоторых гидролитических ферментов (например, пепсина, папаина, химотрипсина) на частично гидролизованные белки. Природа пластеинов и их роль требуют дальнейшего изучения. По-видимому, при синтезе пластеинов возникают новые пептидные связи, и сами продукты представляют собой смеси пептидов.
Гидролитические ферменты катализируют и другие реакции, в результате которых образуются новые пептидные связи. К ним относятся превращения, названные трансамидированием и транспептидированием. Бергман и Френкель-Конрат [477] установили, что катализируемая папаином реакция
![]()
осуществляется путем прямого замещения без предварительного гидролиза бензоилглицинамида на бензоилглицин и аммиак. Это следует из того, что образование бензоилглицинанилида из бензоилглицина и анилина протекает значительно медленнее, чем синтез из бензоилглицинамида и анилина. Фрутон и сотрудники [483—488] обстоятельно исследовали это явление и открыли ряд аналогичных реакций. Фрутон предположил, что механизм этих реакций связан с образованием активированного фермент-субстратного комплекса, который может реагировать либо с водой (что приводит к гидролизу), либо с замещающим соединением (что приводит к реакции переноса):
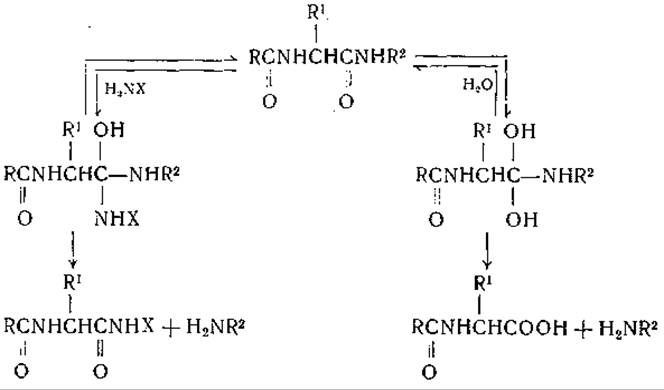
Поэтому вода и замещающие реагенты конкурируют за активированный субстрат. О том, что это не простая конкуренция, свидетельствует чрезвычайно высокая концентрация воды по сравнению с замещающим агентом. Наличие реакций переноса, сопутствующих ферментному гидролизу, — явление общего порядка, наблюдаемое, например, при действии гликозидаз, амидаз и фосфатаз [489—491].
В реакциях, в которых участвуют амиды, замещающим агентом может служить аммиак. Так, например, при инкубировании бензоилглицинамида с папаином в присутствии N15H3 в амидной группе бензоилглицинамида на различных этапах гидролитического процесса был обнаружен изотопный азот. Фрутон и его сотрудники [483—488] наблюдали и другие реакции замещения. Например, при инкубировании бензоилтирозилглицинамида с глицинамидом, меченным N15 в аминогруппе глицина, и с химотрипсином образуется бензоилтирозилглицинамид, содержащий N15-глицин. Оказалось, что гидроксиламин может служить заместителем в реакциях следующего рода:
![]()
Такие реакции были проведены с рядом субстратов (бензоиларгининамид, карбобензоксиизоаспарагин) и с различными ферментами (папаин, катепсин С). Наблюдались также реакции транспептидирования, приводящие к удлинению пептидной цепи. Так, например, было найдено, что катепсин С (из селезенки быка) катализирует полимеризацию глицил-L-фенилаланинамида с образованием нерастворимого продукта, содержащего окта- и декапептиды. Глицил-L-тирозинамид и другие субстраты также подвергаются полимеризации под действием катепсина С. К числу реакций транспептидирования, описанных Фрутоном и сотрудниками, относятся превращения:

Обычно такие реакции переноса протекают с наибольшей скоростью при рН7—8, а гидролиз — при pH около 5. В связи с этим высказано предположение, что основная функция внутриклеточных протеиназ в физиологической зоне pH состоит в катализе реакций переноса.
Хейнс и сотрудники [492] описали систему транспептидирования в листьях капусты, катализирующую превращение:
![]()
Эта ферментная система катализирует также гидролиз глицил- аминокислот. Было найдено, что трипсин и химотрипсин также катализируют реакции транспептидирования [493, 494].
Бреннер и сотрудники [499, 500] нашли, что химотрипсин, который, как известно, обладает эстеразной активностью [495—498], катализирует образование пептидов из эфиров аминокислот. Инкубирование химотрипсина с эфирами аминокислот ведет как к гидролизу, так и к образованию растворимых и нерастворимых пептидов соответствующих аминокислот. Эти реакции явно аналогичны системе транспептидирования (трансамидирования).
Хейнс и сотрудники [492] сообщили, что препараты из некоторых животных тканей способны катализировать образование у-глутамилпептидов из глутатиона и свободных аминокислот согласно уравнению:
![]()
Эти ферментные препараты, кроме того, катализируют медленный гидролиз глутатиона и образующихся y-глутамиламинокислот. Глутатион можно было заменить рядом y-глутамиламинокислот, а также некоторыми аминокислотами. Реакцию эту катализируют экстракты из почек и поджелудочной железы, но не из печени. Первоначально было найдено, что аргинин не проявляет активности в качестве замещающего агента, но в дальнейших работах [501, 502] установлено образование y-глутамиларгинина из аргинина и глутатиона. Херд и Спрингелл [502] пришли к выводу, что реакции гидролиза и переноса катализируются одним и тем же ферментом. Возможно, что образование y-глутамиламинокислот играет роль в синтезе белка, либо стабилизируя те или иные а-пептидные связи и обеспечивая тем самым потенциальный источник а-пептидов, либо осуществляя перестройку y-глутамилпептида в а-глутамилпептид. Подобную перестройку наблюдали в неферментативных системах [503,504]. Сравнение величин включения глицина и y-глутамилглицина в различные препараты животных тканей показало, что глицин включается более активно, чем y-глутамилглииин, включение же других аминокислот при добавлении глутаминовой кислоты или y-глутамилпроизводных повышается лишь незначительно [505]. Эти исследования не исключают существенной роли y-транспептидирования в обмене веществ, однако природа функций этого процесса остается пока неразгаданной.
В то время как роль переноса y-глyтамильных остатков в тканях животных еще не ясна, получены данные, свидетельствующие о том, что с переносом этих групп связан синтез полиглутаминовых кислот, вырабатываемых некоторыми бактериями, например Bacillus subtilis. Уильямс и Торн [506—508] выделили из культуральных фильтратов В. subtilis фермент, который катализирует реакцию переноса y-глyтамильной группы глутамина к D-глутаминовой кислоте или к a-D-глутамил-D-глутаминовой кислоте. При этом образуются ди- и трипептиды, содержащие глутаминовую кислоту. Фермент, по-видимому, использует как D-, так и L-изомеры глутаминовой кислоты. При реакции L-глутамина с D-глутаминовой кислотой реакция переноса происходила более активно, чем гидролитическое расщепление глутамина, причем в качестве продуктов реакции накапливались пептиды, содержащие до шести аминокислотных остатков. Тот же ферментный препарат катализирует гидролиз природного полипептида и перенос у-глутамильных групп от этого полипептида к D-глутаминовой кислоте с образованием у-глутамилглутаминовой кислоты. Последовательные этапы биосинтеза указанного полипептида в клетках В. subtilis требуют дальнейшего изучения, однако имеющиеся данные подтверждают участие в этом процессе реакции переноса у-глутамильных остатков.