Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Синтез пептидных связей
Ацилирование аминокислот
Давно известно, что гиппуровая кислота (бензоилглицин) является нормальной составной частью мочи у ряда животных (например, у лошади, собаки, кролика) и у человека и что введенная в организм бензойная кислота выделяется в основном в виде гиппуровой кислоты. Выделение гиппуровой кислоты после приема определенной дозы натриевой соли бензойной кислоты используется как показатель функционального состояния печени у человека. У птиц (куры) «обезвреживание» бензойной кислоты приводит к выделению орнитуровой кислоты; фенилуксусная кислота у кур также вступает в сочетание с орнитином. У человека после введения фенилуксусной кислоты выделяется фенилацетилглутамин.
Процессы биосинтеза ациламинокислот привлекли интерес не только в связи с их ролью в обмене веществ, но и в связи с тем, что исследование их может дать ценные сведения о биосинтезе пептидной связи. Синтез гиппуровой кислоты был показан сперва в опытах со срезами печени и почек [509]. В тех же срезах осуществляется и аналогичная реакция — синтез n-аминогиппуровой кислоты [510]. Эти реакции были затем изучены и в ферментных системах гомогенатов [510—513]. Участвующие в них ферменты печени локализованы, по-видимому, во фракции митохондрий [511, 514]. Ни бензоилфосфат, ни N-фосфоглицин не используются в этой реакции. Вместе с тем оказалось, что для этой реакции необходим кофермент А [515], и недавно [516] было доказано существование следующих реакций:
1) АТФ + Кофермент А + Бензойная кислота →
→ Бензоил-кофермент А + АМФ + Пирофосфат,
2) Бензоил-кофермент А + Глицин → Бензоилглицин + Кофермент А.
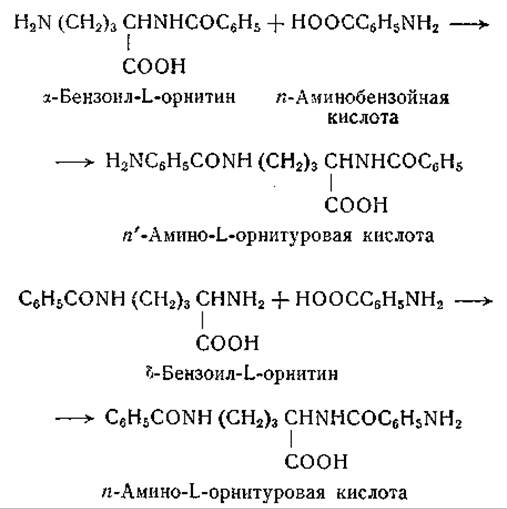
Синтез n-аминоорнитуровых кислот из а- и S-N-бензоилорнитина и n-аминобензойной кислоты изучали Мак-Гилвери и Коэн [517], которые пользовались препаратом цитоплазматических гранул из почек кур. Ферментная система, синтезирующая n-аминоорнитуровую кислоту, во многих отношениях сходна с системой печени крысы, синтезирующей n-аминогиппуровую кислоту. Возможная роль кофермента А в образовании орнитуровых кислот пока не исследована. Описанные выше суммарные реакции можно представить в следующем виде:
В организмах протекает ряд других реакций ацилирования; к ним относится ацилирование цистеина и его производных [518—522] и образование фенилацетилглутамина [523—526]. Ацетилирование глутаминовой кислоты наблюдали у Escherichia coli (стр. 345); реакция, по-видимому, требует наличия кофермента А. Присутствие ацетиласпарагиновой кислоты в ткани мозга кошки указывает на то, что в этой ткани протекает аналогичная реакция (стр. 14). Ацетилирование аминокислот в присутствии цианида наблюдали в опытах с высушенными препаратами клеток Clostridium kluyverii [527]. Дальнейшие исследования указывают на то, что в этой системе непосредственным донатором ацетильной группы является ацетилфосфат и что реакция протекает при участии фосфотрансацетилазы и кофермента А [528].