Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Синтез пептидных связей
Синтез глутатиона
Браунштейн и сотрудники [529] описали синтез глутатиона из глицина, цистеина и глутаминовой кислоты в срезах печени крысы; они наблюдали реальный прирост количества этого трипептида в пробах в результате синтеза. Блох и сотрудники [530—536] обстоятельно изучили реакции, приводящие к синтезу глутатиона. В их ранних исследованиях критерием служило включение меченого глицина и глутаминовой кислоты в глутатион. Позднее было установлено наличие реального синтеза в опытах с очищенными ферментными препаратами и показано, что реакция протекает в два этапа:
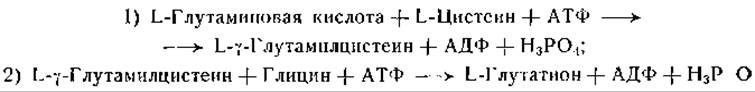
Применяя очищенную ферментную фракцию из печени голубя, указанные авторы нашли, что реакция (2) требует присутствия ионов магния и АТФ и что эту реакцию ускоряют ионы калия. Из дрожжей также был выделен и обогащен примерно в 5500 раз фермент, катализирующий реакцию (2). Опыты с этим ферментом, как и с ферментом из препаратов печени, не дали никаких указаний на участие в этой реакции других кофакторов или на образование не связанного с ферментом промежуточного продукта. Кроме реакции (2), очищенный фермент катализирует также обмен остатков фосфата между аденозиндифосфатом (ADP) и аденозинтрифосфатом (АТР):
![]()
Очищенный дрожжевой фермент катализирует также обмен глицинового остатка глутатиона на свободный глицин и на гидроксиламин:
![]()
Найдено, что для реакций (3) и (4) требуется присутствие аденозиндифосфата и либо арсената, либо фосфата. Таким образом, синтез глутатиона из глутамилцистеина и глицина сходен в некоторых отношениях с синтезом глутамина (стр. 269); обе реакции обратимы. В то время как гидроксиламин может замещать глицин в реакции (2), что приводит к образованию гидроксамовой кислоты, другие аминокислоты и аммиак не активны в этой системе. Механизм синтеза глутатиона из глицина, y-глутамилцистеина и аденозинтрифосфата остается пока неясным. Реакция эта осуществляется печенью различных видов животных [529—532], дрожжами [534], а также Escherichia coli [537] и высшими растениями [538].
Первую ступень синтеза глутатиона, а именно образование у-глутамилцистеина из цистеина и глутаминовой кислоты [реакция (1), см. выше], наблюдали в опытах с ферментными препаратами из зародышей пшеницы [539] и из печени свиньи [536]. Фермент из зародышей пшеницы был подвергнут 50-кратной очистке; показано, что для его действия обязательно присутствие аденозинтрифосфата и ионов магния и калия. Фермент катализирует также включение S35-цистеина в y-глутамилцистеин путем обмена в присутствии аденозинтрифосфата и ионов магния и калия. Сходный фермент получен из печени свиньи; для этой системы не требуется наличия ионов калия, однако ионы магния оказались необходимыми. Ферменты из зародышей пшеницы и из печени свиньи не идентичны ферменту, синтезирующему глутамин. В опытах с ферментом из зародышей пшеницы наблюдали обмен между неорганическим фосфатом и аденозинтрифосфатом в присутствии глутамата, а также обмен фосфатной группой между АДФ и АТФ в отсутствие добавленных аминокислот. Интерпретация этих данных пока затруднительна.