Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Энергетика биохимических реакций
Термодинамика
∆G0 и константа равновесия
Рассмотрим следующее обобщенное химическое уравнение, описывающее реакцию, в ходе которой а молей вещества А реагируют с b молями вещества В, давая продукты С, D и т. д.:
аА + bВ + ... = cC + dD + .... (3-26)
Изменение стандартной свободной энергии для этого процесса равно
![]()
![]() обозначает здесь свободную энергию вещества А и т. д. Значение ∆G для любых заданных концентрации реагентов и продуктов можно получить из ∆G0, используя уравнение (3-23) применительно к каждому из компонентов. В результате мы получим
обозначает здесь свободную энергию вещества А и т. д. Значение ∆G для любых заданных концентрации реагентов и продуктов можно получить из ∆G0, используя уравнение (3-23) применительно к каждому из компонентов. В результате мы получим
![]()
Здесь аC — активность компонента С и т. д. Эго полезное соотношение позволяет рассчитывать ∆G при низких концентрациях веществ, что обычно имеет место в биохимических системах (чаще всего эти концентрации близки к миллимолярным и существенно ниже концентрации гипотетического стандартного раствора, равной 1 М). В уравнение (3-28) обычно прямо подставляют концентрации
![]()
1 Индекс і относится здесь к одному из компонентов раствора, в котором наряду с растворителем могут присутствовать я другие вещества. Если быть точным, ![]() это парциальная молярная свободная энергия, т. е. изменение полной свободной энергии очень большого объема раствора при добавлении в раствор 1 моля данного компонента.
это парциальная молярная свободная энергия, т. е. изменение полной свободной энергии очень большого объема раствора при добавлении в раствор 1 моля данного компонента.
2 Те же уравнения можно относить и к мольным долям.
Уравнение (3-28) пенно и в другом отношении. Если система находится в равновесии, то ∆G = 0, а отношение ![]() есть попросту константа равновесия К. Отсюда следует, что
есть попросту константа равновесия К. Отсюда следует, что
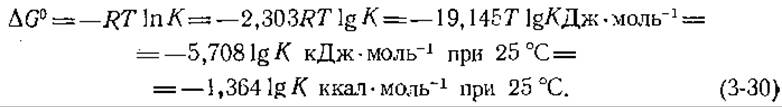
Заметим, что хотя ∆G0 измеряется й кДж∙моль-1, изменение свободной энергии, определяемое уравнением (3-30), относится к реакции, в которой участвуют а молей вещества А, b молей вещества В и т. д.