Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Энергетика биохимических реакций
Термодинамика
Изменение равновесия с температурой
При постоянном давлении ∆G изменяется с изменением температуры согласно следующему уравнению:
![]()
Соответствующие изменения К описываются уравнением Вант-Гоффа
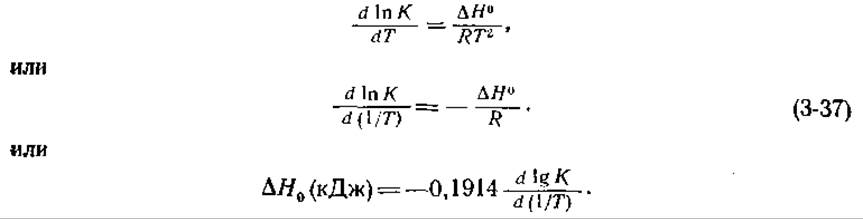
Если в интервале температур, соответствующем условиям эксперимента, ∆Н0 можно считать постоянным, то график зависимости In/С от 1/T позволяет определить ∆Н0 (или ∆Н', если график построен для lnK'): наклон прямой равен —∆H0/R. Поскольку, зная К, можно рассчитать ∆G0, с помощью уравнения (3-14) можно определить далее ∆S0. Однако этот метод дает низкую точность, и поэтому лучше прямо измерять ∆Н калориметрически. Кроме того, предположение о постоянстве ∆Н0 в значительном интервале температур, в особенности для белков, может оказаться неверным.