Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Энергетика биохимических реакций
Таблицы значений ∆G0 для биохимических соединений
Потенциалы переноса групп
Напомним, что равновесие в реакциях синтеза биополимера из мономеров (будь то амиды, эфиры, фосфодиэфиры или гликозиды) обычно сдвинуто в сторону расщепления, а не образования полимера. Положение равновесия зависит от конкретных структур. Некоторые связи при достаточно высоких концентрациях мономеров образуются легко, другие практически никогда не образуются в сколько-нибудь заметном количестве. Соответственно и гидролиз в равновесии может быть лишь частичным, а может достигать 99,9%.
Рассмотрим гидролиз двух органических фосфатов — аденозинтри-фосфата (АТР) и глюкозо-6-фосфата (структурные формулы этих соединений приведены на рис. 7-1).
Таблица 3-4 Значения pKa, ∆G0 и ∆Н0 для ионизации кислот при 25°Са,б
|
Кислота |
РКа |
∆G0, кДж∙моль-1 |
∆H0, кДж∙моль-1 |
|
Муравьиная кислота |
3,75 |
21,4 |
0,04 |
|
Уксусная кислота |
4,76 |
27,2 |
-0,1 |
|
Пропионовая кислота |
4,87 |
27,8 |
-0,6 |
|
Молочная кислота |
3,97 (35 °С) |
23,4 |
2,2 |
|
Пировиноградная кислота |
2,49 |
14,2 |
12,1 |
|
NH+4 |
9,25 |
52,8 |
52,2 |
|
CH3NH+4 |
10,59 |
60,4 |
55,4 |
|
Аланин |
|||
|
-СООН |
2,35 |
13,4 |
3,1 |
|
—NH+3 |
9,83 |
56,1 |
45,4 |
|
ß-Аланин |
|||
|
—СООН |
3,55 |
20,3 |
4,5 |
|
—NH3(кажущееся) |
10,19 |
58,2 |
|
|
L-алаиил-L-аланин |
3,34 |
19,1 |
-0,5 |
|
Аспарагиновая кислота |
|||
|
—СООН |
2,05 |
11,7 |
7,7 |
|
—COOH |
3,87 |
22,1 |
4,0 |
|
-NH+3 |
10,60 |
60,5 |
38,8 |
|
Н2СO3 |
6,35в |
36,2 |
9,4 |
|
Н3РО4 |
10,33 |
59,0 |
15,1 |
|
РК1 |
2,12 |
12,1 |
-7,9 |
|
рК2 |
7,18г |
41,0 |
3,8 |
|
(кажущееся) |
6,78д |
38,7 |
3,3 |
|
рК3 |
12,40 |
70,8 |
17,6 |
|
Глицеро-1-фосфат, рК2 |
6,66 |
38,0 |
-3,1 |
|
Глюкозо-6-фосфат |
6,50 |
37,1 |
-1,8 |
|
Пирофосфорная кислота, H4P2О7 |
|||
|
рК3 |
6,7 |
38,1 |
-1 ,3 |
|
(кажущееся) |
6,12д |
34,9 |
0,5 |
|
РК4 |
9,4 |
53,6 |
-7,1 |
|
(кажущееся) |
8,95д |
51,2 |
1,7 |
|
Аденозин |
3,5 |
20,1 |
13,0 |
|
АМР |
|||
|
pК1 (кольцо; кажущееся) |
3,74д |
21,3 |
4,2 |
|
рК2 (фосфат) |
6,67г |
38,1 |
3,6 |
|
(кажущееся) |
6,45д |
36,8 |
3,6 |
|
ADP |
|||
|
рК2 (кольцо; кажущееся) |
3,93д |
22,4 |
4,2 |
|
рК3 (дифосфат) |
7,20г |
41,1 |
-5,7 |
|
(кажущееся) |
6,83е |
39,0 |
-5,7 |
|
АТР рК3 (кольцо; кажущееся) |
4,06 |
23,2 |
0 |
|
pK4 (трифосфат) |
7,68г |
43,8 |
-7,0 |
|
(кажущееся) |
7,00г |
40,2 |
-7,0 |
|
Пиридин |
5,17 |
29,5 |
20,1 |
|
Фенол |
9,98 |
56,9 |
23,6 |
а Приведены значения термодинамических величин, соответствующие бесконечно разбавленным растворам, если специально не оговаривается, что это — кажущиеся значения. Последние соответствуют ионной силе 0,2—0,25.
б Большая часть данных взята из издания Handbook of Biochemistry and Molecular Biology, 3rd ed., Vol. I (G. D. Fasman, ed.), pp. 305—351, © CRC Press, Inc., Cleveland, 1976.
в В этом случае pK1 соответствует K1 = [Н+][НСО-3]/([СО2] + [Н2СО3]); Forster R. Е., Edsall J. Т., Otis А. В., Roughton F. J. W., eds., NASA, Spec. Publ., 188, 1969.
г Phillips R. C, George P., Rutman R. J., Biochemistry, 2, 501—508, 1963.
д Alberty R. A., JBC, 244, 3290—3302, 1969.
e Данные, которыми пользуется Alberty R. (Alberty R. A., in: Horizons of Bioenergetics, pp. 135—147, Academic Press, New York, 1972), вычислены для ионной силы 0,2 с помощью уравнений, приведенных в статье Phillips R. С., George Р., Rutman R. J., JACS, 88, 2631—2640, 1966.
Обратите внимание, что уменьшение свободной энергии в ходе гидролиза для АТР вдвое больше, чем для глюкозо-6-фосфата. Глюкозофосфат термодинамически более устойчив, чем АТР. По сравнению с АТР его легче получить с помощью реакции, обратной гидролизу, и биосинтез его тоже должен протекать легче. Кроме того, как это следует из свободной энергии гидролиза, в присутствии соответствующего катализатора фосфорильная группа может самопроизвольно перейти с АТР на глюкозу, но не наоборот.
Поскольку уменьшение свободной энергии в процессе гидролиза служит количественной термодинамической характеристикой способности группы к переносу на другой нуклеофил (гл. 7), ее иногда называют потенциалом переноса. Так фосфорильная группа
АТР в процессе гидролиза переносится на гидроксил-ион воды с потенциалом переноса 32,9 кДж∙моль-1. Вода — это произвольно выбранный, но общепринятый стандартный нуклеофил, относительно которого определяется потенциал переноса. Перенос групп играет важную роль в процессах энергообмена и биосинтеза биополимеров; поэтому биохимики довольно часто пользуются потенциалом переноса (отрицательной свободной энергией гидролиза) биохимических соединений. Значения этой величины для ряда соединений приведены в табл. 3-5.
Таблица 3-5 Свободная энергия гидролиза некоторых соединений при 25 °С (в кД∙жмоль-1)а

а Все данные (если нет специальных указаний) взяты из статьи Jencks W. Р., inr Handbook of Biochemistry and Molecular Biology, 3rd ed., Vol. I (G. D. Fasman, ed.), pp. 296—304, CRC Press, Inc., Cleveland, 1976. В случае высвобождения в ходе реакци». одного протона ∆G0 составляет —39,96 кДж∙моль-1.
б Guynn R. W., Veech R. L., JBC, 248, 6966—6972, 1973.
в При расчете использовано ∆G° = +11,80 ккал∙моль-1 для гидролиза до Р2О4-7 плюс ∆G0диссоциации НР2О3-7, взятое из статьи Alberty R. A., JBC, 244, 3290—3324, 1969. Однако к 11,80 ккал∙моль-1 прибавлено еще 1,017 ккал∙моль-1, чтобы привести данные в соответствие с данными по гидролизу АТР до ADP.
г Alberty R. A., Horizons of Bioenergetics, Academic Press, New York, 1972., pp. 135—147.
д George P., Witonsky R. J., Frachtman M., Wu C., Dorwart W., Richman L., Richman W., Shurayh F., Lentz В., BBA, 223, 1—15, 1970.
е Расчет основан на значении ∆GObs = 3,0 ккал∙моль-1 для реакции Ацетилфосфат+СоА→Ацетил-СоА+Рі [Stadtman Е. R., in: The Enzymes (P. D. Boyer, ed.), 3rd ed., Vol. 8, pp. 1—49, Academic Press, New York, 1973], а также на значении ∆G' (pH 7) для гидролиза ацетил-СоА.
ж Оценка получена из ∆G0гидролиза АТР и ∆G' = -19,9 кДж∙моль-1 для реакции, катализируемой 3-фосфоглицераткиназой (Burton К., Krebs Н. A., BJ, 54, 94— 107, 1953; 59, 44—46, 1955).
э Оценка получена по данным при pH 7,7 и 8,0 (из таблиц Дженкса).
и В работе Guynn R. W., Gelberg Н. J., Veech R. L., JBC, 248, 6957—6965, 1973 значение ∆G°=—35,75 кДж∙моль-1 дано для 38 °С. Не зная ∆Н, ввести соответствующую поправку, чтобы получить ∆G0 для 25 °С, очень трудно. Согласно работе Burton К., BJ, 59, 44—46, 1955, ∆G' (pH 7) для реакции АТР4-+Ацетат- + СоА→ADP3-+ Ацетил-СоА+НРО2-4 для 25 °С примерно равно 0. В работе [11] для этой реакции при 38°С получили значение —0,56 кДж∙моль-1. Именно эта величина при 25°С использована для получения приведенного здесь значения. Это эквивалентно мало обоснованному предположению, что ∆Н гидролиза АТР и ацетил-СоА примерно одинаковы.
к Эта величина, как и в таблицах Дженкса, на 2 ккал∙моль-1 более отрицательна, чем для ацетил-СоА.
Дополнение 3-А
Аденилатная система
Центральную роль в энергообмене клеток всех типов играет аденилатная система, которая включает в себя трифосфат, дифосфат и 5'-монофосфат аденозина (АТР, ADP и АМР соответственно), а также неорганический фосфат (Pi) и ионы магния. Аденозинтрифосфат является термодинамически неустойчивой молекулой и гидролизуется с образованием ADP
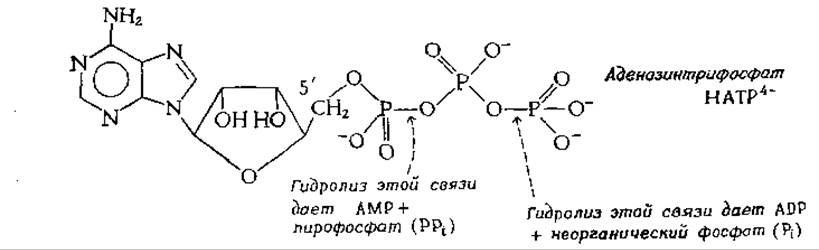
или АМР, как это изображено на приведенной выше схеме. Именно эта неустойчивость (высокий потенциал переноса) позволяет АТР выполнять функцию переносчика химической энергии, необходимой для удовлетворения большей части энергетических потребностей клеток, включая и энергию, нужную для совершения мышечной работы.
Фосфоангидридная (пирофосфатная) связь в молекуле АТР образуется путем соединения ADP и неорганического фосфата, которое осуществляется в ходе ряда специфических реакций фосфорилирования. Наиболее важными из них являются реакции, протекающие в фотосинтезирующих мембранах хлоропластов, а также реакции в мембранах бактерий и митохондрий, сопровождающиеся потреблением кислорода. Превращение АМР в ADP осуществляется путем переноса концевой фосфорильной группы с АТР на АМР (гл. 7) в ходе реакции, катализируемой присутствующим во всех клетках необычайно активным ферментом аденилаткиназой. Ниже схематически изображены специфические реакции фосфорилирования, которые в два этапа превращают одну молекулу АМР в молекулу АТР.
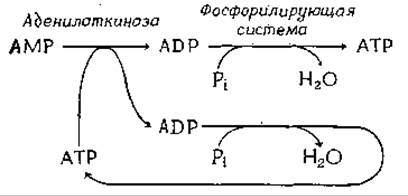
Для оценки потенциала фосфорилирования аденилатной системы внутри клеток предлагалось использовать несколько разных показателей. В качестве одного из них было взято соотношение [ATP]/[ADP][Pi] (названное степенью фосфорилирования Rp). Оно непосредственно связано со свободной энергией гидролиза АТР [уравнение (3-28)]. Величина Rp внутри клетока может достигать значения 103 М-1, что дает вклад в ∆G гидролиза АТР, равный —22,8 кДж∙моль-1. Аткинсон с сотр.б-г предложили другую величину, так называемый «энергетический заряд», представляющий собой мольную долю адениловой кислоты, «заряженной» путем превращения ее в АТР. При этом ADP рассматривается как «полузаряженная» форма.
![]()
Энергетический заряд может меняться от нуля, когда присутствует только АМР, до 1,0, что означает превращение в АТР всех молекул АМР. Измерения, выполненные на целом ряде клеток и тканейг, показывают, что энергетический заряд обычно лежит в пределах от 0,75 до 0,90. Найти численное значение этой величины не составляет труда, однако, к сожалению, она оказывается не связанной с химическими уравнениями. Предположение о важной роли энергетического заряда клетки в регуляции метаболизма весьма сомнительно».
Замечания по поводу сокращений. Следует помнить, что через Pi обозначают смесь ионных форм фосфорной кислоты, присутствующих в растворе при данных условиях. В интервале pH от 4 до 10 это Н2РО-4 (рК'а = 6,8) и HPO2-4. То же относится и к обозначениям AMP, ADP и АТР; под PPi подразумевают смесь ионов пирофосфорной кислоты. Выше pH 4,4 в заметном количестве присутствуют только Н2Р2О2-7 (рK'а = 6,1), НР2O3-7 (рK'a = 9,0) и Р2О4-7.
Насколько известно, пирофосфат в клетках обычно быстро гидролизуется под действием пирофосфатазы на две молекулы Pi. Это тоже одна из важных функций аденилатной системы (гл. 7, разд. Д.1).
Как положения равновесия, так и скорости реакций аденилатной системы зависят от концентраций ионов металлов. Особенно велика роль ионов магния, причем для многих ферментов, катализирующих реакции с участием АТР, истинными субстратами считаются комплексы MgATP2-.
а Eilerman L. J., Slater Е. С., ВВА, 216, 226—228 (1970).
б Swedes J. S., Sedo R. J., Atkinson D. E., JBC, 250, 6930—6938 (1975).
в Shen L. C., Fall L., Walton G. M., Atkinson D. E., Biochemistry, 7, 4041—4045 (1968).
г Chapman A. G., Falt L., Atkinson D. E., J. Bacteriol., 108, 1072—1086 (1971).
д Purich D. L., Fromm H. J., JBC, 248, 461—466 (1973).