Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Энергетика биохимических реакций
Таблицы значений ∆G0 для биохимических соединений
«Константы», изменяющиеся с изменением pH
В уравнении (3-42), описывающем гидролиз НАТР3- с образованием HADP2-и Н2РО-, указанная стехиометрия имеет место лишь при значениях pH вблизи 6. При pH выше ~7 большая часть АТР находится в форме АТР4- и распадается до НРО2-4согласно следующему уравнению:

Значение ∆G° = + 5,4 кДж∙моль-1 для этой реакции вовсе не является тем большим отрицательным числом, каким оно должно быть для самопроизвольной реакции. Все дело здесь в том, что в числе продуктов реакции оказались ионы водорода, а стандартным состоянием для Н+ является не 10-7 М, а 1 М раствор. Поэтому биохимики часто предпочитают пользоваться кажущимися константами диссоциации и кажущимися ∆G; в этом случае за стандартное состояние для ионов водорода принимается состояние, соответствующее значению pH, при котором проводится эксперимент, обычно pH 7. Получаемая таким образом pH-зависимая константа равновесия обозначается К' и определяется так:
![]()
Если в ходе реакции высвобождается один протон, как в уравнении (3-44), то будет выполняться следующее соотношение:
∆G' = ∆G° — 5,708∙pH кДж∙моль-1 при 25 °С. (3-46)
Вспомним, что ∆G' =—RT ln К', и еще заметим, что [Н+] не входит в выражение для К' [уравнение (3-45)]. При ∆С °= +5,4 кДж∙моль-1 получаем, что в ходе гидролиза АТР при 25 °С и μ = 0,25, согласно уравнению (3-46), ∆G'(pH7) =—34,5 кДж∙моль-1 = —8,26 ккал∙моль-1. (3-47)
В биохимической литературе нередко используется ряд других стандартных состояний. Константа равновесия, часто обозначаемая в литературе через Kobs[наблюдаемая (observed) константа], связана с суммарной концентрацией всех ионных форм каждого из компонентов, существующих при данном pH. Так,
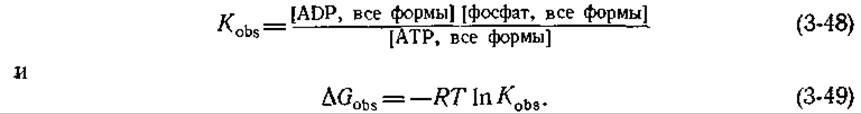
Изменение свободной энергии ∆Gobs можно связать с ∆G', исходя из соотношений между Kobsи К'. Для гидролиза АТР в интервале значений pН 2—10 Kobsесть
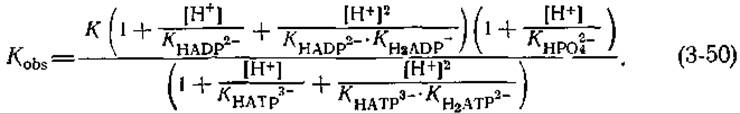
В этом уравнении KHADP2- и т. д. — константы отдельных стадий диссоциации (табл. 3-4). Выражения в скобках — это pH-функции Михаэлиса (см. также гл. 6, разд. Д.5). Они связывают полную концентрацию данного компонента с концентрацией наиболее диссоциированной формы. Так, при pH в интервале от 2 до 10
![]()
Используя кажущиеся значения рКа (р = 0,2) для Н2РО-4, HADP2-и НАТР3-, равные соответственно 6,78; 6,83 и 7,06 (табл. 3-4), мы получим, что при pH 7 ∆Gobs= —35,0 кДж∙моль-1(приняв при этом, что при pH 7 ∆G' = —34,5 кДж∙моль-1). Различие между ∆G' и ∆Gobs в этом примере невелико, но оно было бы заметно больше, если бы ионные формы, фигурирующие в уравнении (3-44), при pH 7 не являлись преобладающими.
Чтобы найти изменение свободной энергии реакции в условиях, отличных от стандартных, следует применить уравнение (3-28). Так, при pH 7 и 0,01 М активностях ADP3-, АТР4- и НРО2-4 ∆G гидролиза АТР, согласно уравнению (3-44), равно —34,5—2∙5,71=—45,9 кДж∙моль-1 = —11,0 ккал∙моль-1. Следовательно, для концентраций, имеющих место в клетках (как правило, это миллимоли), потенциал переноса АТР существенно выше, чем при стандартных условиях.
Чтобы найти ∆G для температуры, отличающейся от 25 °С, необходимо знать ∆H реакции. Используя уравнение (3-37), легко показать, что ∆G для температуры T2 связано с ∆G для температуры Т1 следующим соотношением:
![]()
Энтальпия гидролиза АТР, согласно уравнению (3-44), равна —19,7 кДж∙моль-1. Используя это значение и применяя уравнение (3∙52), находим1, что ∆G' (pH 7) гидролиза АТР для 38 °С равно —35,2 кДж∙моль-1. Следует помнить, что все указанные здесь изменения свободной энергии — это кажущиеся величины, относящиеся к растворам с ионной силой ~0,25.
1 Точное значение ∆С (pH 7) для 25 °С, использованное для получения приведенного здесь результата, равно —34,54 кДж∙моль-1. Почти такое же значение получил автор этой книги, исходя из ∆G' = —35,19 кДж∙моль-1 для 38 °С, приведенного в работе [11].