Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Количественная оценка прочности связывания
Несколько центров связывания в одной молекуле
Из названия этого раздела может показаться, что его тема не столь уж актуальна, однако в действительности это не так, поскольку молекулы в живых организмах очень часто взаимодействуют более чем с одной молекулой, и именно это обстоятельство позволяет им функционировать. Сначала рассмотрим простейшую ситуацию, когда макромолекула Р последовательно связывается с одной молекулой X, затем со второй, с третьей и т. д. до n молекул.
Обозначим константы образования, соответствующие каждой из этих стадий, через K1, K2,..., Кn,
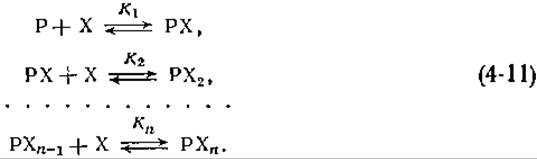
Выражение для константы образования, соответствующей i-й стадии, имеет вид
![]()
Напомним, что величина ![]() — это доля центров, занятых лигандами.
— это доля центров, занятых лигандами.
Число молей X, связанных с одним молем Р, равно ![]() oно получается суммированием концентраций [РХ]+2[РХ2]+... и делением полученной суммы на сумму концентраций всех форм макромолекулы Р.
oно получается суммированием концентраций [РХ]+2[РХ2]+... и делением полученной суммы на сумму концентраций всех форм макромолекулы Р.
Для двух центров связывания (n = 2)
![]()
В общем случае
![]()
Суммирование проводится по всем і от 1 до n. Выражая концентрацию каждого компонента [РХ2] через концентрации свободных форм [X] и [Р] и через константы образования, соответствующие отдельным стадиям, получаем (для n = 2)
![]()
Аналогичное уравнение может быть записано и для общего случая. Обратите внимание, что концентрация Р не входит в уравнение (4-15), т. е. ![]() является функцией только [X] и констант образования, соответствующих отдельным стадиям. Tакие уравнения описывают изотермы связывания двух или большего числа молекул X с Р. Из экспериментально полученного графика, построенного в координатах {[X] (или lg[X]);
является функцией только [X] и констант образования, соответствующих отдельным стадиям. Tакие уравнения описывают изотермы связывания двух или большего числа молекул X с Р. Из экспериментально полученного графика, построенного в координатах {[X] (или lg[X]); ![]() (или ∆А)) иногда удается определить константы образования для соответствующих стадий — K1, K2, K3 ... Kn. Однако реально решить такую задачу оказывается довольно сложно. Чтобы упростить уравнение (4-15) и соответствующее уравнение для общего случая, сгруппируем константы образования и обозначим произведения констант (K1, K1K2, K1K2K3... и т. д.) соответственно через φ1, φ2, φ3 и т. д. При этом наши уравнения примут следующий вид:
(или ∆А)) иногда удается определить константы образования для соответствующих стадий — K1, K2, K3 ... Kn. Однако реально решить такую задачу оказывается довольно сложно. Чтобы упростить уравнение (4-15) и соответствующее уравнение для общего случая, сгруппируем константы образования и обозначим произведения констант (K1, K1K2, K1K2K3... и т. д.) соответственно через φ1, φ2, φ3 и т. д. При этом наши уравнения примут следующий вид:
для n = 2
![]()
в общем случае
![]()
Из экспериментальных данных часто легче сначала определить произведения констант образования ψ (их всего n), а затем вычислить сам» константы. Например,
K1 — ψ1, K2 = ψ2/K1 и т. д. (4-18)
С первого взгляда может показаться, что уравнение (4-17) (уравнение Эдера) полностью описывает процесс связывания, однако, как правило, это не так. Зачастую в макромолекуле имеются центры связывания более чем одного типа, а уравнение (4-17) ничего не говорит нам о характере распределения лиганда X между различными центрами в комплексе РХ. Более того, если n велико, то невозможно экспериментально определить все n констант. Чтобы проанализировать оба вопроса, рассмотрим микроскопические константы связывания.