Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Мембраны и клеточные оболочки
Строение мембран
Физические свойства мембран, обусловленные наличием в них липидов
Полностью вытянутая цепочка жирной кислоты, содержащей 18 атомов углерода (рис. 5-1), имеет длину приблизительно 2 нм. Площадь, занимаемая такой молекулой в проекции «с торца», составляет 0,20 нм2. Следовательно, толщина углеводородного слоя в липидном бислое, содержащем такие цепочки жирных кислот, должна быть равна ~4 нм. Экспериментально же измеренная толщина миелиновых мембран оказалась равной ~3,5 нм, однако в случае мембран наружного членика палочек сетчатки глаза она не превышала 1,8 нм, а в искусственных черных пленках, полностью лишенных растворителя, составляет 3,1 нм [15]. Эти, а также многие другие результаты позволяют считать, что углеводородные цепочки в мембране полностью не распрямлены, вследствие чего площадь, занимаемая мембраной, несколько больше, чем это можно было предполагать, исходя из элементарной модели, согласно которой цепочки жирных кислот полностью вытянуты. Преобладание в мембране цис-изомеров ненасыщенных жирных кислот и других молекул типа стеринов или белков способствует образованию складок, благодаря чему уменьшается толщина мембраны. Предположение о том, что толщина биологических мембран больше той, которую им следовало иметь, если бы их строение соответствовало элементарной модели, подтверждается результатами измерений толщины липидных монослоев в плазматических мембранах. Согласно полученным данным, поперечное сечение молекулы фосфолипида составляет в среднем 0,52 нм2, тогда как в случае компактной упаковки оно должно было бы составлять ~0,40 нм2 (2Хпоперечное сечение одной вытянутой цепочкой) [16].
При достаточно низких температурах липидные бислои ведут себя как твердые тела. Согласно рентгеноструктурным данным, толщина бислоя составляет 0,42 нм, что соответствует гексагональной упаковке цепочек жирных кислот. При температуре, превышающей температуру перехода (Tt), толщина бислоя возрастает до 0,46 нм. Структура бислоя при этом сохраняется, однако жирные кислоты «плавятся», в результате чего вращение и скручивание молекул происходит легче, чем при низких температурах [16а]. Плавление мембранных липидов было непосредственно продемонстрировано несколькими методами. Например, при температурах, превышающих Tt, атомы водорода метальных и метиленовых групп боковых цепей жирных кислот дают узкие сигналы в протонных и в 13С-ЯМР-спектрах мембран.
Резкое уширение этих полос при температуре ниже Tt обусловлено потерей подвижности углеводородных цепей (дополнение 5-А). Аналогичные выводы были сделаны при исследовании спин-меченых бислоев, содержащих ковалентно связанные стабильные свободные радикалы, неспаренные электроны которых можно обнаружить методом электронного парамагнитного резонанса (ЭПР, ом. дополнение 5-Б).
Температура перехода, или «плавления», липидных бислоев зависит от состава содержащихся в них жирных кислот. Для насыщенных жирных кислот с длинной цепью характерны высокие температуры перехода. Миелину присуще особенно высокое содержание сфинголипидов с длинными цепями и холестерина, которые, как известно, повышают стабильность искусственных бислоев. В сущности, состояние миелиновых мембран в организме человека приближается к твердому.
Температура перехода бислоев часто может быть достаточно четкой. Однако тщательные исследования показали, что, как и в случае кристаллов с примесями, плавление начинается, по существу, задолго до Tt. Так, более высокая растворимость парамагнитного 2,2,6,6-тетраметилпиперидин-1-оксида в жидких участках бислоя по сравнению с твердыми позволяет изучать процесс плавления бислоев путем нагревания мембраны непосредственно в ЭПР-апектрометре по изменению растворимости этого спин-меченого соединения (дополнение 5-Б). Для дипальмитоилфосфатидилхолина (лецитина) величина Тt равна 40,5° С,
однако первые признаки плавления можно заметить значительно раньше — при температуре 29,5 °С [17]. Аналогичные данные были получены методом «флуоресцентного зонда», с помощью которого измеряли интенсивность флуоресценции N-фенилнафтиламина, зависящую от полярности его окружения (гл. 13, разд. В.1). При включении этого соединения в мембрану интенсивность его флуоресценции значительно возрастает. Полученные данные указывают на то, что и при температуре < Tt внутри бислоя одновременно существуют жидкие и твердые области [17а]. Это явление носит название латеральное разделение фаз [17]. Равновесие между твердыми и жидкими состояниями является динамическим и в значительной степени зависит от ионного состава среды, окружающей бислой. Имеются основания предполагать, что явление латерального разделения фаз играет фундаментальную роль в процессе проведения нервных импульсов [18].
Дополнение 5-А
Времена релаксации в спектроскопии магнитного резонанса
В современной литературе, посвященной исследованию мембран, ферментов и конформации небольших молекул, часто встречаются термины время продольной и поперечной релаксации и время корреляции. Для того чтобы понять значение этих терминов, необходимо ознакомиться с оригинальными работамиа-д; написанное ниже следует рассматривать лишь как краткое введение.
Первоначальной целью ЯМР-спектроокопии было получение спектра (высокого разрешения, в котором магнитный момент каждого ядра регистрировался бы в виде четкого сигнала или сигналов поглощения. Минимальная ширина сигналов ограничивается принципом неопределенности Гейзенберга, согласно которому ∆E∙∆t = h/2п, где h — постоянная Планка, ∆Е — неопределенность в энергии, a ∆t — время жизни возбужденного магнитного состояния. Поскольку для электромагнитного излучения E=hv, величина ∆Е прямо пропорциональна ширине сигнала. Ядро, обладающее собственным магнитным моментом, хорошо экранировано от внешних воздействий, и время его жизни в возбужденном состоянии может быть сравнительно велико. Отсюда следует, что величина ∆v должна быть мала, часто она составляет менее 0,2 Гц. Это обстоятельство способствует успешному
использованию протонного магнитного резонанса высокого разрешения (см., например, рис. 2-40 и 2-41).
Если приложить к образцу в спектрометре ЯМР очень мощный импульс электромагнитного излучения, то практически все ядра могут перейти в возбужденное магнитное состояние. Если сразу вслед за этим приложить еще один импульс, то поглощение энергии будет невелико, так как система насыщена. В наиболее широко применяемых спектрометрах ЯМР для уменьшения эффекта насыщения используют радиочастотное поле малой интенсивности. Однако в импульсных ЯМР-спектрометрах с фурье-преобразованием. применение мощных импульсов приводит к высокой степени насыщения. Использование повторных импульсов не позволяет получать полезную информацию, если возбужденные ядра не релаксируют достаточно быстро в состояние, характеризующееся равновесным распределением энергии. Релаксация происходит за счет взаимодействий ядер с флуктуирующими магнитными полями окружения. Релаксация органических молекул в растворе происходит в основном за счет флуктуаций, обусловленных движением электрических диполей, находящихся в непосредственной близости. Однако даже при наличии таких взаимодействий времена релаксации протонов в воде могут измеряться секундами.
Релаксацию магнитных состояний ядра характеризуют двумя временами. Время продольной релаксации, или время спин-решеточной релаксации Т1, определяет скорость релаксации суммарного магнитного вектора ядер в направлении магнитного поля спектрометра (Н0). Время поперечной, или спин-спиновой релаксации Т2, характеризует релаксацию в плоскости, перпендикулярной направлению Н0. При определенных условиях два времени релаксации могут быть измерены независимо. В общем случае Т2≤Т1. Для твердых тел время Т2 невелико (оно составляет приблизительно 10-5 с), тогда как для растворов, как уже упоминалось, оно может измеряться секундами. Столь значительное увеличение времени жизни возбужденного состояния при переходе от твердого состояния к жидкому приводит к сужению сигналов поглощения, что играет важную роль в ЯМР-впектроскопии. Это объясняет, почему обычно узкие для жидкостей сигналы ЯМР-спектров уширяются при увеличении вязкости или уменьшении текучести мембраны.
Как можно измерить Т2 и T1? В первом приближении для жидкостей Т2 часто оценивают по ширине сигнала ∆v на его полувысоте:
![]()
Однако обычно для этого используют специальные импульсные методы ЯМР. Проще всего величину T1 измерить на спектрометре с фурье-преобразованием в присутствии изотопа 13С. Часто времена T1и Т2 пытаются использовать для получения информации о динамических характеристиках системы. В этом случае определяют взаимосвязь между Т1 или Т2, с одной стороны, и временем корреляции тс для исследуемых ядер — с другой. Величина тс — это временная константа, характеризующая экспоненциальное затухание флуктуаций в среде, ответственных за релаксацию магнитных ядер. В общем случае 1/тс можно рассматривать как константу скорости, представляющую сумму всех констант скоростей для различных независимых процессов, приводящих к релаксации. Наиболее важный из этих процессов — молекулярная переориентация, для которой 1/r = (3kT) (4пηr3). Обратите внимание на сходство этого уравнения с уравнением, описывающим вращательную диффузию [уравнение (6-32)]. Другим параметром является величина, обратная времени контакта (residence) тm, характеризующая среднее время, в течение которого пара диполей находится достаточно близко друг от друга, для того чтобы могла произойти релаксация.
В обычных растворителях при комнатной температуре тс составляет 10-12 с. Следовательно, скорости релаксации в растворе значительно выше, чем частоты излучения, поглощаемого в ЯМР-спектрометре (~108 с-1). В этих условиях релаксация относительно неэффективна, а времена Т1 и Т2 велики и в большинстве случаев равны друг другу. Сигналы при этом остаются узкими. С увеличением времени корреляции (например, при увеличении вязкости) времена Т1 и Т2 уменьшаются; время T1 достигает минимума, когда величина тc-1 равна частоте поглощаемого излучения v. В этих условиях сигналы уширяются и сверхтонкие линии (обусловленные взаимодействием магнитных спинов различных ядер) сливаются и не могут быть разрешены. По мере дальнейшего увеличения тс время Т2 уменьшается и достигает постоянного Минимального значения, тогда как время T1 вновь увеличивается. Измерения методам ЯМР могут проводиться в области, в которой тс-1 больше v. Эта возможность реализуется в высокочастотных спектрометрах, чем и обусловлено их преимущество. Вместе с тем с жидкостями обычно принято работать при условии сильного сужения, связанного с высокой подвижностью, при низких значениях тс-1. С увеличением подвижности молекул возрастают значения как Т1, так и Т2.
Серьезное ограничение при использовании методов ЯМР для исследования белков связано с увеличением времени корреляции молекулярной переориентации для больших молекул. Поскольку наибольший вклад в константу скорости релаксации вносит чаще всего 1/тr, узкие сигналы в спектре ЯМР появляются лишь при исследовании небольших белков, мол. вес которых не превышает 20 000б.
Практическая трудность, возникающая при исследованиях методом ЯМР с использованием изотопа 13С, связанная с медленной релаксацией (большим значением T1), обусловлена частичным насыщением. В результате на тех атомах углерода, для которых релаксация особенно неэффективна, наблюдаются сигналы меньшей интенсивности. Времена релаксации могут быть измерены отдельно для каждого атома углерода в молекуле. Правильная интерпретация полученных данных дает ценную информацию о подвижности определенных фрагментов и групп внутри молекулы. Следует отметить, что соотношения между временами релаксации и внутримолекулярными движениями носят сложный характер, однако ситуация часто упрощается при использовании 13С-ЯМР. Поскольку атомы углерода обычно окружены связанными с ними водородными атомами, релаксация ядер в значительной мере определяется диполь-дипольными взаимодействиями с этими атомами. Для атома углерода, связанного с N эквивалентными протонами, для которых характерна очень быстрая молекулярная переориентация,
![]()
где h = h/2п, а ус и ун — гиромагнитные отношения ядер углерода и водорода. Это соотношение позволяет рассчитать эффективное время корреляции т для каждого углеродного атома.
Примером такого рода интерпретации служит работа Гудмена и сотр.ж. Некоторые проблемы, связанные с интерпретацией ширины сигналов в спектрах ЯМР мембран, рассмотрены в работе Сейтера и Ченаз.
а Bovey F. A., Nuclear Magnetic Resonance Spectroscopy, Academic Press, New York, 1969.
б Farrar T. C., Becker E. D., Pulse and Fourier Transform NMR, Academic Press, New York, 1971.
в Swift J. T., Tech. Chem., 6, Part II, 521—563 (1974).
г Lyerla J. R., Jr., Grant D. M. In: Magnetic Resonance, (McDowell C. A, ed.), MTP Int. Rev. Sсi. No. 4, pp. 155—200, Butterworth, London, and Univ. Park Press, Baltimore, 1972.
д Lee A. G., Birdsall N. J. M., Metcalfe C. In: Methods in Membrane Biology (Korn E. D., ed.), Vol. 2, pp. 1—156, Plenum, New York, 1974.
e Gray G. A., CRC Crit. Rev. Biochem., 1, 247—364 (1973).
ж Goodman R. A., Oldfield E., Allerhand A., JACS, 95, 7553—7558 (1973).
3 Selter С. H. A., Chan S. I., JACS, 95, 7541—7553 (1973).
Считают, что во всех организмах при физиологической температуре липидные компоненты большинства мембран частично находятся в жидком состоянии [19]. Жидкое состояние липидов в мембране объясняется по крайней мере тремя причинами. 1. В организме человека (так же как и у Е. coli) имеются ненасыщенные жирные кислоты, понижающие температуру плавления; мутанты Е. coli, не способные синтезировать ненасыщенные жирные кислоты, не могут жить в среде, лишенной этих соединений [20]. 2. у Bacillus subtilis, которые не содержат ненасыщенных жирных кислот при выращивании при 37 °С, и у других грамположительных бактерий более 70% жирных кислот в мембране содержит дополнительные метильные группы (гл. 12, разд. Д) [21]. Подобно двойным связям в цис-конфигурации, дополнительные метильные группы способствуют понижению температуры плавления и увеличению площади поверхности монослоя в 1,5 раза.
3. Понижение температуры плавления липидов может быть обусловлено также тем, что в их состав входят циклопропансодержащие жирные кислоты (гл. 12, разд. Д.1).
Вместе с тем наличие в мембранах холестерина приводит к ограничению подвижности молекул и к уменьшению площади, занимаемой молекулами фосфолипидов [22].
Почему мембранные липиды должны обладать подвижностью? Одна из причин связана, вероятно, с участием мембран в жизненно важных процессах транспорта. Биологические мембраны характеризуются довольно высокой проницаемостью для нейтральных молекул (в том. числе Н2О), причем при температурах, превышающих Тt, цепи жирных кислот могут свободно поворачиваться вокруг одинарных связей на 120 °С, переходя из транс- в скошенную (гош-) конфигурацию. В результате такого вращения вокруг соседних или близко расположенных связей возникают «изломы» цепочек жирных кислот. Если излом образуется вблизи поверхности бислоя (как это чаще всего и происходит), то в образовавшуюся полость легко может проскочить небольшая молекула. Поскольку излом легко перемещается по бислою, небольшие- молекулы могут свободно проникать через мембрану [23]. Не исключено, что эти же факторы обеспечивают перенос и более крупных молекул, играющих роль переносчиков в мембранном транспорте.
Молекулы липидов и белков, входящих в состав мембран, способны перемещаться друг относительно друга. Скорость латеральной диффузии липидов в бислоях и антигенов (белков) на поверхностях клеток весьма высока. Если предположить, что диффузия фосфолипидjв происходит за счет взаимного обмена соседних молекул, то частотах таких обменов может достигать 107 с-1 [24].
Экспериментальные данные, полученные методами ЯМР и ЭПР, показывают, что наружные участки бислоев находятся как бы в более твердом состоянии, чем внутренние. По-видимому, не случайно первая, двойная связь в полиненасыщенных жирных кислотах встречается обычно между 9-м и 10-м углеродными атомами. В результате двойные связи в жирных кислотах галактозилдиглицеридов в хлоропластах оказываются на таком же расстоянии от поверхности мембраны, как и. метальные группы цепей фитола в хлорофилле. Считают, что в «расплавленном» центре бислоя находятся области с нерегулярной структурой, образующиеся за счет метальных групп цепей фитола (рис. 13-19). Последние входят в мембраны хлоропластов [25] и фиксируют там. молекулы хлорофилла1.
Дополнение 5-Б
Спектры электронного парамагнитного резонанса (ЭПР) и спиновые метки
Поскольку неспаренные электроны обладают магнитными моментами, они являются удобными объектами для магнитно-резонансной спектроскопии. Ее методическая часть в принципе сходна с ЯМР-спектроскопией, однако в ЭПР-спектроскопии используют электромагнитные волны с частотами ~1010 Гц (диапазон СВЧ), энергия которых приблизительно в 100 раз превышает энергию волн, используемых в ЯМР-опектроскопииа-в. Неспаренные электроны имеются у свободных радикалов органических молекул, а также у некоторых переходных металлов. Оба этих класса соединений имеют важное значение для ряда ферментативных процессов. Кроме того, к различным участкам макромолекул можно присоединить спиновые метки — стабильные органические радикалы. При помощи методов ЭПР или ЯМР часто удается регистрировать взаимодействия неспаренных электронов таких искуcственно встроенных радикалов с магнитными моментами неспаренных электронов или ядер.
1 Эта точка зрения отражает лишь одну из предложенных теорий; другие возможные объяснения рассмотрены в гл. 3, разд. Д 3.
Условия поглощения энергии в ЭПР-спектрометре задаются уравнением ![]() которое по форме идентично основному уравнению ЯМР-спектроскопии. Здесь ß — константа, которую называют магнетоном Бора. Величина g-фактор спектроскопического расщепления—представляет собой одну из наиболее важных характеристик, используемых при описании спектра ЭПР. Для свободного электрона значение g-фактора равно 2,000, для радикалов оно может быть несколько иным, а для ионов переходных металлов отличие иногда весьма значительно. Одним из факторов, обусловливающих зависимость g-фактора от окружения, является спин-орбитальное взаимодействие, связанное с несимметричностью р- и d-орбиталей атомов. По той же причине g-фактор иногда принимает три дискретных значения для трех разных направлений (анизотропия g-фактора). В других случаях значение g-фактора в направлении, параллельном H0(g‖), отличается от его значения в перпендикулярном направлении (g⊥). Оба этих значения могут быть определены экспериментально.
которое по форме идентично основному уравнению ЯМР-спектроскопии. Здесь ß — константа, которую называют магнетоном Бора. Величина g-фактор спектроскопического расщепления—представляет собой одну из наиболее важных характеристик, используемых при описании спектра ЭПР. Для свободного электрона значение g-фактора равно 2,000, для радикалов оно может быть несколько иным, а для ионов переходных металлов отличие иногда весьма значительно. Одним из факторов, обусловливающих зависимость g-фактора от окружения, является спин-орбитальное взаимодействие, связанное с несимметричностью р- и d-орбиталей атомов. По той же причине g-фактор иногда принимает три дискретных значения для трех разных направлений (анизотропия g-фактора). В других случаях значение g-фактора в направлении, параллельном H0(g‖), отличается от его значения в перпендикулярном направлении (g⊥). Оба этих значения могут быть определены экспериментально.
Еще одной характеристикой спектра ЭПР является сверхтонкая структура, происхождение которой связано с взаимодействием между магнитным моментам неспаренного электрона и спинами ядер. Это взаимодействие аналогично спин-спиновому взаимодействию в ЯМР (гл. 2, разд. 3). Константа сверхтонкого расщепления А, так же как и константа взаимодействия J в ЯМР-спектроскопии, выражается в герцах Расщепление обусловлено наличием магнитного момента у ядра, вокруг которого вращается электрон, или у расположенного поблизости ядра, а также присутствием другого неспаренного электрона. Иногда наличие или отсутствие расщепления позволяет делать важные в химическом плане заключения. Так, в спектре ЭПР иона металла в комплексе расщепление под воздействием ядер лиганда будет наблюдаться только в том случае, если лиганд связан с ионом ковалентной связью
Обычно в ЭПР-cпектроскопии используют не кривую поглощения, а ее первую производную. Например, в случае иминоксильной спиновой метки спектр ЭПР состоит из трех равно отстоящих друг от друга линий. Их центры находятся в точках, где производные кривых поглощения пересекают горизонтальную ось. Взаимодействие со спином ядра 14N приводит к расщеплению на три линии, как это показано на представленном ниже рисунке.
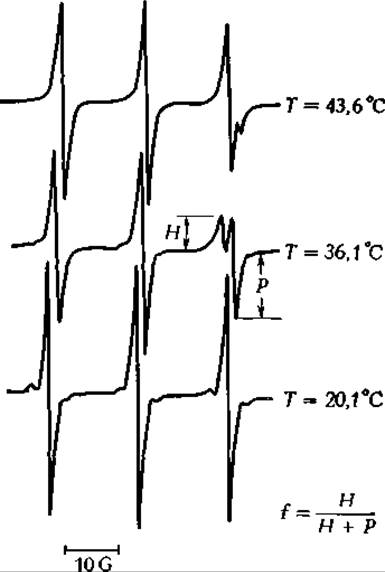
Спектр ЭПР тетра метил пиперидин-1-оксида (разд A4), растворенного в водной эмульсии фосфолипидов. Вверху — при температуре выше Tt; в центре — между Tt и предпереходной температурой, внизу — при температуре ниже "предпереходной»г.
(Напечатано с разрешения American Chemical Society Biochemistry, 12,2553, 1973.)
Нижний из трех спектров приближается к спектру спиновой метки в воде, тогда как два других являются более сложными спектрами, характерными для состояний, при которых часть метки растворена в фоофолипидных бислоях.
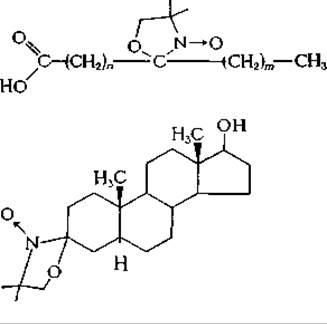
Поскольку частоты, используемые в ЭПР-спектроскопии, приблизительно в 100 раз выше, чем в ЯМР-спектроскопии, для получения четких спектров времена корреляции (дополнение 5-А) не должны превышать 10-9 с. Хотя четкие спектры можно получить и для растворов, все-таки, чтобы затормозить движение молекул, образцы замораживают и измерения проводят при очень низких температурах. При исследовании спиновых меток в липидных бислоях ширина и вид линий служат чувствительными критериями характера движения молекул, которое может быть как хаотичным, так и направленным. Для сопоставления формы линий, полученных при различных условиях, с предсказанными на основании определенных теорий уширения линий часто с успехом используют вычислительные машиныд,е. К числу спиповых меток, включающихся в липидные бислои, относятся следующие соединения:
Интерпретация наблюдаемых изменений в ЭПР-спектрах спиновых меток носит в большинстве случаев чисто эмпирический характер. Например, при интерпретации спектров, показанных на представленном выше рисунке, можно считать, что при высоких температурах в липиде растворяется большее количество спиновой метки, чем при более низких. Отношение, указанное на рисунке, представляет собой эмпирический параметр, температурную зависимость которого можно оценить из опытов, проведенных при разных температурах. Графики, отражающие зависимость f от Т, были использованы для определения температуры перехода и предпереходной температуры в бислояхг.
а Knowles Р. F., Essays Biochem., 8, 79—106 (1972).
б Chen К. S., Hirota N.. Tech. Chem., 6, Part II, 565—636 (1974).
в Griffith О. H., Waggoner A. S., Acc. Chem. Res., 2, 17—24 (1969).
г Shimshick E. I., McConnell H. M., Biochemistry, 12, 2351—2360 (1973).
д Deraux P., McConnell H. M., JACS, 94, 4475—4481 (1972).
e Sackmann E., Trouble H., JACS, 94, 4482—4498 and 4499—4510 (1972).