Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Нуклеиновые кислоты
Кольцевые и суперспиральные структуры; интеркаляция
Молекулы ДНК могут существовать не только в виде открытых, незамкнутых молекул; часто их концы ковалентно соединяются друг с другом. Так, хромосома Е. coli представляет собой единое замкнутое кольцо. Кольцевые молекулы ДНК часто обнаруживаются в митохондриях, а также в некоторых вирусах [80].
Как и у белков, структуру ДНК можно значительно исказить путем внесения дополнительных супервитков (суперспиралей). Чтобы получить такой эффект, к одному из концов цепи необходимо приложить крутящий момент. Так, если взять слегка скрученное свободно провисающее резиновое кольцо и закрутить его сильнее (как это делают при подготовке к полету аэромоделей), произойдет положительная суперспирализация. Аналогичная ситуация — образование положительных (или отрицательных) суперспиралей (третичная спирализация) — может иметь место и в ДНК. Суперспирали часто встречаются в кольцевых молекулах ДНК. При «закручивании» нормального двуспирального комплекса (дуплекса) общее число оборотов a (the winding number) одной нити относительно другой равно числу витков во вторичной структуре ß, которое соответствует ненапряженному спиральному дуплексу (т. е. структуре Уотсона — Крика), плюс число супервитков т:
a = τ + ß. (2-14)
Величина ß всегда положительна, но х может быть и отрицательным— в этом случае образование полностью сформированной вторичной структуры (спираль Уотсона — Крика) сопровождается появлением некоторого числа левоспиральных супервитков [81].
Плотность супервитков (степень суперспиральности) молекулы ДНК обычно выражают величиной σ, равной числу супервитков на 10 пар оснований [80, 82]. Для встречающихся в природе кольцевых молекул ДНК σ чаще всего отрицательна; наиболее типичное ее значение —0,05 (~5 супервитков на 1000 пар оснований). Присутствие супервитков в кольцевых молекулах ДНК можно легко установить, поскольку при этом меняется константа седиментации ДНК [81]. Так, суперспиральная природная ДНК вируса полиомы седиментирует довольно быстро. После внесения разрыва в одну из цепей двойной спирали посредством кратковременной обработки ее ферментом образуется «релаксированная» форма молекулы, которая седиментирует медленнее. Суперспиральность сказывается на вязкости растворов ДНК, а также на электрофоретической подвижности молекул (рис. 2-27,А) [82а]. В некоторых случаях наличие супервитков можно наблюдать с помощью электронного микроскопа.
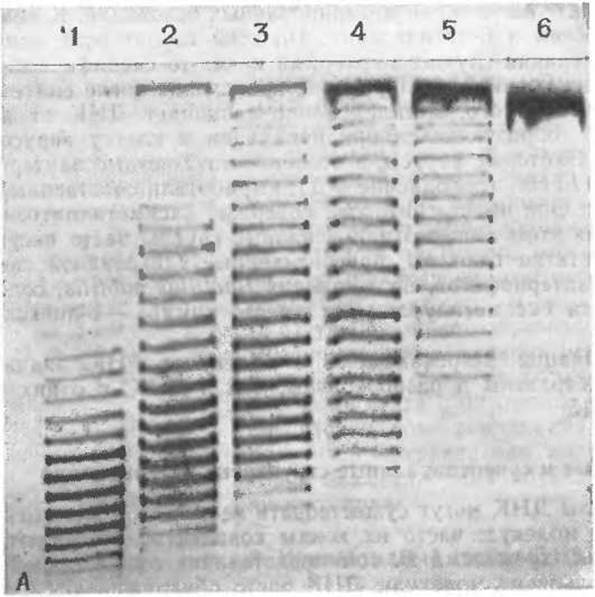
РИС. 2-27. А. Электрофорез препарата ДНК вируса SV 40 (дополнение 4-В), представляющего собой смесь молекул с различным числом супервитков. Молекулы нативной ДНК (электрофореграмма 1) быстро движутся к аноду в виде серии полос, каждая из которых отличается от соседней по числу супервитков в соответствующей ДНК на 1. Среднее число супервитков равно 25. Инкубация ДНК в присутствии «релаксационного» фермента (гл. 15, разд. Д.1) вызывает последовательное уменьшение числа супервитков: фермент вносит одноцепочечные разрывы и тут же снова сшивает цепь. Инкубация ДНК с этим ферментом при 0°С в течение 1, 3, 6, 10 и 30 мин (электрофореграммы 2—6) постепенно переводит ДНК в форму со средним числом супервитков, равным нулю [82]. Электрофорез проводили в смеси 0,5%-його агарозного геля и 1,9%-ного полиакриламидного геля; размер пластинки—17Х18X0,3 см. Для выявления полос электрофореграммы окрашивали флуоресцирующим интеркалирующим красителем этидиумбромидом. (С любезного разрешения W. Keller.)
Чем обусловлено образование супервитков в природных ДНК? Ключ к решению этого вопроса дают исследования интеркаляции [83—86] — встраивания плоских ароматических колец между парами оснований ДНК. Способностью к такой интеркаляции обладают многие лекарственные препараты (в частности, антибиотики), красители и другие вещества. К их числу относятся дауномицин, профлавин, этидиумбромид и гикантон (рис. 2-27,Б). Гикантон, одно из наиболее широко применяемых в мире лекарств, употребляется при лечении шистосомоза (гл. 1, разд. Д.1). Поскольку интеркалирующие соединения обладают мутагенным действием, применение таких лекарств связано с определенным риском.
Интеркаляция часто используется для оценки степени отрицательной суперспиральности молекул ДНК. Добавляя возрастающие количества интеркалирующего агента, следят за тем, как изменяется константа седиментации (или другие свойства) ДНК. По мере возрастания степени интеркаляции происходит раскручивание витков вторичной структуры ДНК [ß в уравнении (2-14)]. Каждое интеркалирующее кольцо вызывает раскручивание спирали на ~26°. Поскольку для замкнутого ковалентного дуплекса значение а [уравнение (2-14)] постоянно, понижение ß при возрастании интеркаляции ведет к увеличению т. Когда интеркаляция достигнет уровня, при котором т повысится до 0, будет наблюдаться минимальная скорость седиментации. Дальнейшее добавление интеркалирующего агента приведет к положительной суперспирализации.
«Репликативная форма» ДНК вируса — Х174 (дополнение 4-В) — небольшая кольцевая молекула из ~5000 пар оснований — обрабатывалась профлавином [82]. Связывание 0,06 молей профлавина на моль нуклеотидов сводило т к нулю. Отсюда была получена оценка1δ = 0,055; это означает, что при температуре 25°, pH 6,8 и ионной силе ~0,2 в молекуле содержится —26 супервитков. На плотность супервитков сильно влияют температура, pH и ионный состав. В общем случае σ становится менее отрицательной на ~ 3,3X10-4 при повышении температуры на 1° [86с]. Например, для ДНК вируса —Х174 при ионной силе 0,2 а получалась равной —0,059 при 15 °С и —0,040 (—19 супервитков) при 75°С.
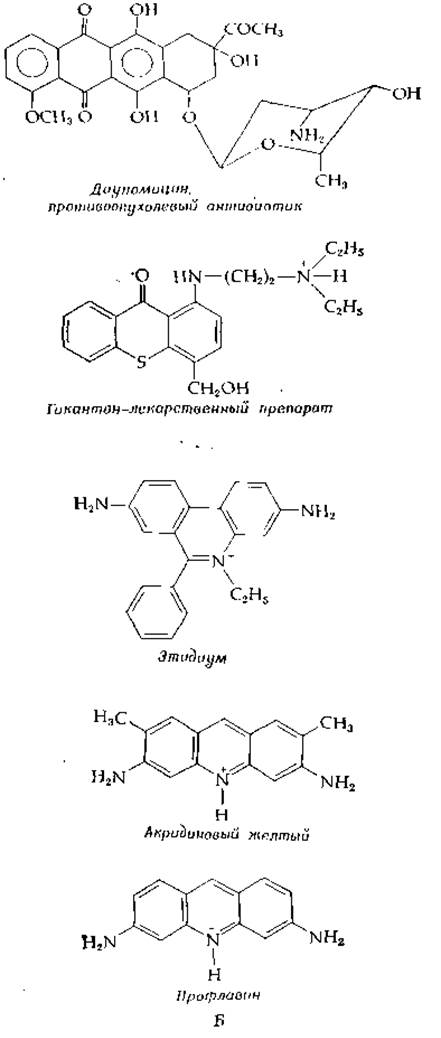
РИС. 2-27. Б. Структурные формулы ряда интеркалнрующих соединений (см. также структуру комплекса актиномицнн — ДНК (дополнение 15-Б).
1 Приведенная здесь оценка основана на том, что интеркаляция одной молекулы профлавииа дает угол раскручивания ~16°; для сравнения отметим, что этидиумбромид приводит к раскручиванию на 26°. В более ранней литературе угол раскручивания для этидиумбромида принимался равным 12° и получавшаяся в результате плотность супервитков (12σ) оказывалась ниже приводимых теперь (26σ) [84, 86а, b].
Недавно выполненные исследования показали, что при электрофоретическом разделении как природных, так и искусственно полученных суперспиральных молекул ДНК часто выявляется примерно 10 форм, каждая из которых отличается от другой на один виток суперспирали (рис. 2-27,А). Относительное содержание этих топологически изомерных форм примерно соответствует гауссову распределению. Считается, что изомеры появляются в результате тепловых флуктуаций степени суперспиральности в момент ферментативного замыкания цепи ДНК в кольцо.
Сопряжена ли интеркаляция плоских молекул в цепи нуклеиновых кислот с какой-либо биохимической функцией? По-видимому, да. Например, в белках, взаимодействующих с нуклеиновыми кислотами, ароматические кольца боковых цепей аминокислот могут встраиваться между плоскостями оснований в спиральной структуре ДНК наподобие закладок внутри книги [85, 86]. Изменения в плотности супервитков, вызванные интеркаляцией или изменением ионного окружения, могут играть роль в соблюдении нужной последовательности во взаимодействии ДНК с внутриклеточными ферментными системами.