Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Нуклеиновые кислоты
Денатурация и гибридизация
Подобно белкам, нуклеиновые кислоты могут денатурировать. Этот процесс состоит в расхождении цепей двойной спирали ДНК и двухспиральных участков молекулы РНК (в частности, тРНК; рис. 2-24). Денатурацию можно вызвать добавлением кислоты, щелочи, спиртов или удалением стабилизирующих структуру молекулы противоионов, например Mg2+. В результате денатурации каждая из цепей молекулы приобретает форму беспорядочно свернутого клубка, поэтому данный процесс называют переходом спираль—клубок. Тепловая денатурация нуклеиновых кислот, как и белков, носит кооперативный характер (гл. 4, разд. В.7) и происходит в довольно узком интервале температур; характерным параметром процесса является температура плавления.
Температурная зависимость поглощения УФ-света при 260 нм (длина волны, при которой свет поглощается нуклеиновыми кислотами эффективнее всего) называется кривой плавления (рис. 2-28). В нативном состоянии нуклеиновые кислоты поглощают свет менее интенсивно, чем в денатурированном. Этот так называемый гипохромный эффект (гл. 13, разд. Б.4.д) обусловлен стэкинг-взаимодействием между основаниями, плотно уложенными стопками в структуре нативной молекулы. Температура плавления, Тпл, — это точка, при которой прирост поглощения составляет половину максимального (рис. 2-28). Чем выше GC-содержание нуклеиновой кислоты, тем более устойчива она к денатурации, причем зависимость Тпл от GC-содержания почти линейна. Для раствора, содержащего 0,15 М NaCl + 0,015 М цитрата натрия, pH 7,0, справедливо уравнение (2-15). Точное соотношение между GC-содержанием ДНК и Тпл очень сильно зависит от ионного состава и рн среды [87, 88].
![]()
Полная денатурация молекулы ДНК приводит к расхождению комплементарных цепей. При быстром охлаждении раствора денатурированной ДНК цепи остаются в разделенном состоянии. Однако, если в течение какого-то времени поддерживать температуру чуть ниже значения Тпл (этот процесс называют отжигом), может вновь восстановиться нативная структура. Этот факт дает в руки ученым очень важный метод исследования нуклеиновых кислот, основанный на образовании гибридных дуплексов [89, 90].
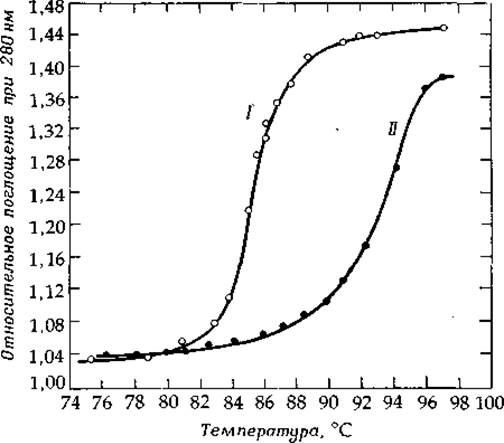
РИС. 2-28. Кривые плавления ДНК из двух разных источников — Pneumococcus (кривая 1) и Serratia (кривая II). (Davidson J. N., The Biochemistry of Nucleic Acids, 7th ed., p. 148, Academic Press, New York, 1972).
Одним из типов двойных спиралей, которые получают искусственным путем, является гибрид ДНК—РНК. Оказалось, что молекулы информационной (матричной) РНК (мРНК) гибридизуются только с одной из двух разделившихся цепей ДНК, несущей участки, комплементарные мРНК. Метод гибридизации используется также для получения гетеродуплексов ДНК, в которых две цепи молекулы происходят от двух разных генетических линий одного и того же вида организмов. Известно, что некоторые мутации состоят в делении (выпадении) или вставке одного или нескольких оснований в цепь ДНК. Гетеродуплексы, в которых одна из цепей нативная, а другая — со вставкой или делецией, имеют по всей своей длине нормальную структуру по Уотсону—Крику, за исключением тех участков, где делении или вставки нарушают комплементарность и образуются одноцепочечные петли (рис. 15-24).
Опыты по гибридизации позволили исследовать гомологичность нуклеиновых кислот из разных источников. Вначале молекулы расщепляют (например, с помощью ультразвука) на фрагменты длиной ~ 1000 нуклеотидов и подвергают денатурации. Фрагменты денатурированной ДНК смешивают с денатурированной ДНК из другого источника. Участки ДНК разных видов, имеющие близкие нуклеотидные последовательности, в той или иной степени гибридизуются, тогда как участки с сильно различающимися последовательностями гибридизации не поддаются. Рассмотрим один из вариантов постановки таких экспериментов. Денатурированную ДНК определенного организма, не подвергавшуюся деградации, заключают в агаровый гель [90] или наносят на нитроцеллюлозный фильтр [91]. Фрагменты ДНК из другого источника пропускают через колонку с ДНК-содержащим агаром или через фильтр с абсорбированной ДНК. Комплементарное спаривание соответствующих фрагментов задерживает их на колонке или фильтре, тогда как фрагменты, не нашедшие себе «партнеров», свободно проходят дальше.
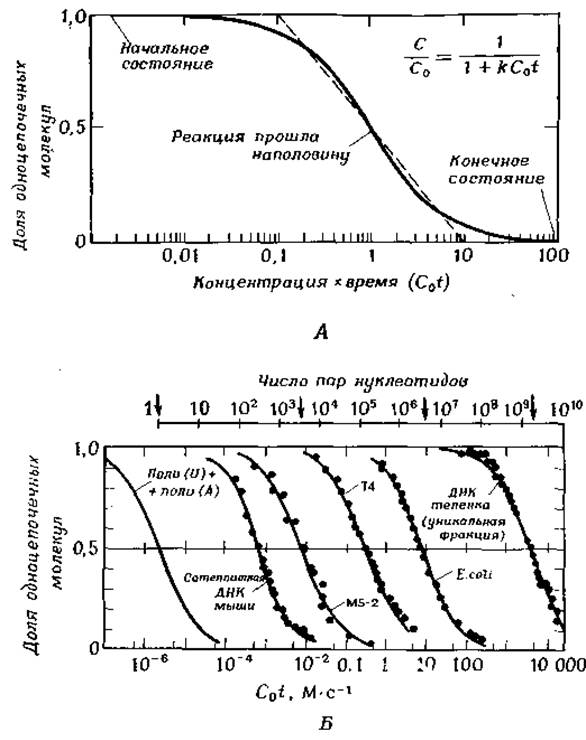
РИС. 2-29. Кривые реассоциации ДНК (Britten R. J., Kohne D. E., Science, 161, 1968; Britten R. J., Smith J.). А. Временной ход идеальной реакции второго порядка с указанием основных характеристик графика, построенного в указанных координатах. Уравнение дает долю одноцепочечных молекул ДНК в данный момент времени после начала реакции. В начале реакции эта доля принята равной единице, и далее показана ее зависимость от произведения суммарной концентрации ДНК на время (логарифмическая шкала). Б. Кривые реассоциации двухцепочечных молекул нуклеиновых кислот из разных источников. Размер генома указан стрелками на шкале вверху. Вплоть до 109 эта величина пропорциональна C0t в момент, когда реакция прошла наполовину. ДНК фрагментирована (длина фрагмента ~400 нуклеотидов в цепи). При построении кривых введена поправка, приводящая скорости реакции к тем, какие имели бы место при концентрации ионов натрия 0,18 М. Реассоциация проводилась при оптимальной температуре, т. е. на ~30° ниже Тпл. Степень реассоциации определяли по оптическому вращению (ДНК тимуса теленка), устойчивости к рибонуклеазе (MS-2) и гипохромному эффекту.
Очень ценным является изучение кинетики реассоциации фрагментированной денатурированной ДНК [92—95]. Этот процесс подчиняется кинетике второго порядка (гл. 6, разд. А.З), описываемой уравнением (2-16). Его легко получить, проинтегрировав уравнение (6-8) в интервале от 0 до t при [А] = [В] = С.
C/C0 = 1/(1 + kC0t). (2-16)
Это соотношение связывает начальную концентрацию денатурированной ДНК С0 с концентрацией С молекул ДНК, оставшихся диссоциированными к моменту времени t. Данные по реассоциации удобно представлять в виде графика зависимости относительного числа реассоциированных молекул от C0t в логарифмическом масштабе (рис. 2-29, А). Как видно из рис. 2-29, Б, C0t увеличивается прямо пропорционально длине генома ДНК, но иногда наблюдается сильное отклонение от этой зависимости, обусловленное наличием в молекуле большого числа повторов [поли(й) или поли (А)]. Наклон кривых в средней точке характеризует степень гетерогенности фрагментов ДНК в растворе (гл. 15, разд. И.1).