Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Кетокислоты и другие необычные электрофильные центры
Гистидин- и фенилаланиндезаминазы (аммиак-лиазы)
Возвращаясь к стадии а в уравнении (8-32), отметим следующее: структура субстрата такова, что вряд ли можно было ожидать легкого элиминирования а-аминогруппы. Таким образом, не удивительно, что в ферменте L-гистидин — аммиак-лиаза имеется особый активный центр, как и в L-фенилаланин — аммиак-лиазе. Последняя элиминирует NH3 -группу вместе с пpo-S-водородом в ß-положении с образованием транс-коричной кислоты:
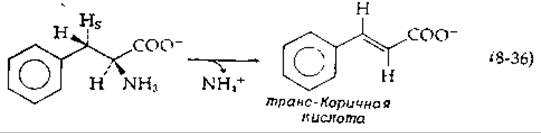
Последняя образуется в высших растениях и превращается в ошеломляюще большое число производных (дополнение 12-Б; гл. 14, разд. 3.6). Если в ß-положение ввести 2Н, то кинетический изотопный эффект не обнаруживается. По-видимому, лимитирующей стадией является освобождение аммиака из коферментной группы, и фермент должен каким- то образом существенно улучшить свойства аминогруппы как уходящей группы.
Оба фермента ингибируются боргидридом натрия, а также нитрометаном. Имеются данные, что оба фермента содержат N-концевые остатки дегидроаланина, аминогруппы которых существуют в форме шиффовых оснований, возможно с альдегидными группами, возникающими при окислении боковых цепей остатков серина [65, 66]. Предложен возможный механизм действия ферментов, основанный на этом допущении. Выдвинуто предположение о возможном участии переходного металла [66а].
Все механизмы, описанные в этом разделе, следует рассматривать как чисто гипотетические. Поскольку все они включают аномальную реакционноспособность связанных кетокислот, то на деле все обстоит, по-видимому, сложнее.