Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Коферменты переноса водорода
Одной из наиболее универсальных реакций биологического окисления является дегидрирование алкоголя до кетона или альдегида:
![]()
В начале этого века было обнаружено, что два удаляемых атома водорода перемещаются на водородпереносящие коферменты, такие, как никотинамидадениндинуклеотид (NAD)1), никотинамидадениндинуклеотидфосфат (NADP), флавинадениндинуклеотид (FAD) и рибофлавин-5'-фосфат (называемый также флавинмононуклеотидом, FMN).
При восстановлении NAD только один из атомов водорода, удаляемых из молекулы алкоголя, связывается ковалентно с NAD, превращая его в NADH, тогда как другой становится свободным протоном:
![]()
Исследование 2Н-меченых алкоголей и их окисления под действием NAD показало, что дегидрогеназы катализируют прямой перенос к NAD+ водорода, который связан с углеродом спиртовой группы. Кроме того, не обнаружено обмена водорода с какими-либо протонами среды.
1) NAD часто называли дифосфопирндиинуклеотидом (DPN), a NADP называли TPN. Многие биохимики предпочитают эти старые названия, и они еще нередко появляются в биохимической литературе.
В то же время водород, присоединенный к кислороду спирта, освобождается в среду в виде Н+:

Упомянутые выше наблюдения дают основание рассматривать эти акты биологического окисления (процессы дегидрирования) как удаление гидрид-иона Н- совместно с протоном Н+, а не как удаление двух атомов водорода. Таким образом, NAD+ и NADP+ обычно рассматривают как коферменты, акцептирующие гидрид-ион. Тем не менее важно учитывать, что оказалось невозможным установить окончательно, происходит ли перенос атома водорода к этим коферментам до или после переноса электрона или же протон и электроны переносятся одновременно, т. е. в форме Н-.
Еще менее ясна картина в случае флавиновых коферментов FAD и рибофлавинфосфата. Однако, каков бы ни был истинный механизм реакции, удобно классифицировать большинство актов метаболического переноса водорода с позиции переноса гипотетического гидрид-иона. Гидрид-ион можно считать нуклеофилом, который может присоединяться к двойным связям или отщепляться от субстратов в реакциях тех типов, которые уже были рассмотрены и которые перечисляются в табл. 8-3. Хотя все реакции представлены в направлении восстановления, многие из них являются обратимыми, а некоторые обычно протекают в направлении, противоположном тому, которое представлено в таблице.
Почему существуют четыре основных кофермента переноса водорода (NAD+, NADP+, FAD и рибофлавинфосфат), а не только один?
Ответ отчасти заключается в том, что восстановленные пиридин-нуклеотиды NADPH и NADH являются более сильными восстановителями, чем восстановленные флавины (табл. 3-7). И наоборот, флавиновые коферменты являются более сильными окислителями, чем NAD+ и NADP+. Флавиновые коферменты построены на основе витамина рибофлавина, а пиридиновые нуклеотиды — на основе никотин-амида. Структуры этих двух витаминов, несомненно, отобраны природой с тем, чтобы придать коферментам надлежащие окислительно-восстановительные потенциалы (гл. 3, разд. В). Однако не все так просто. NAD+ и NADP+ проявляют тенденцию к существованию в клетке в свободных формах, диффундируя от одного фермента к другому. Флавиновые же коферменты обычно прочно связаны с белками и не способны к передвижению. Таким образом, они стремятся акцептировать атомы водорода от одного субстрата и передать их второму субстрату, оставаясь присоединенными к одному и тому же ферменту.
Окислительно-восстановительный потенциал системы пиридиннуклеотидных коферментов определяется стандартным окислительно-восстановительным потенциалом свободного кофермента в сочетании с отношением концентраций окисленной и восстановленной форм кофермента [NAD+]/[NADH] [уравнение 3-64)]. Следовательно, можно определить истинный потенциал системы NAD+ в клетке. Окислительновосстановительный потенциал может быть различным в разных частях клетки вследствие различий в отношении [NAD+]/[NADH], но внутри данного участка клетки он является постоянным. В то же время окислительно-восстановительные потенциалы флавопротеидов сильно варьируют. Поскольку флавиновые коферменты не отщепляются от белка, два флавопротеида могут действовать при сильно отличающихся потенциалах, даже если они располагаются близко друг к другу.
Таблица 8-3 Некеторые реакции переноса водородаа
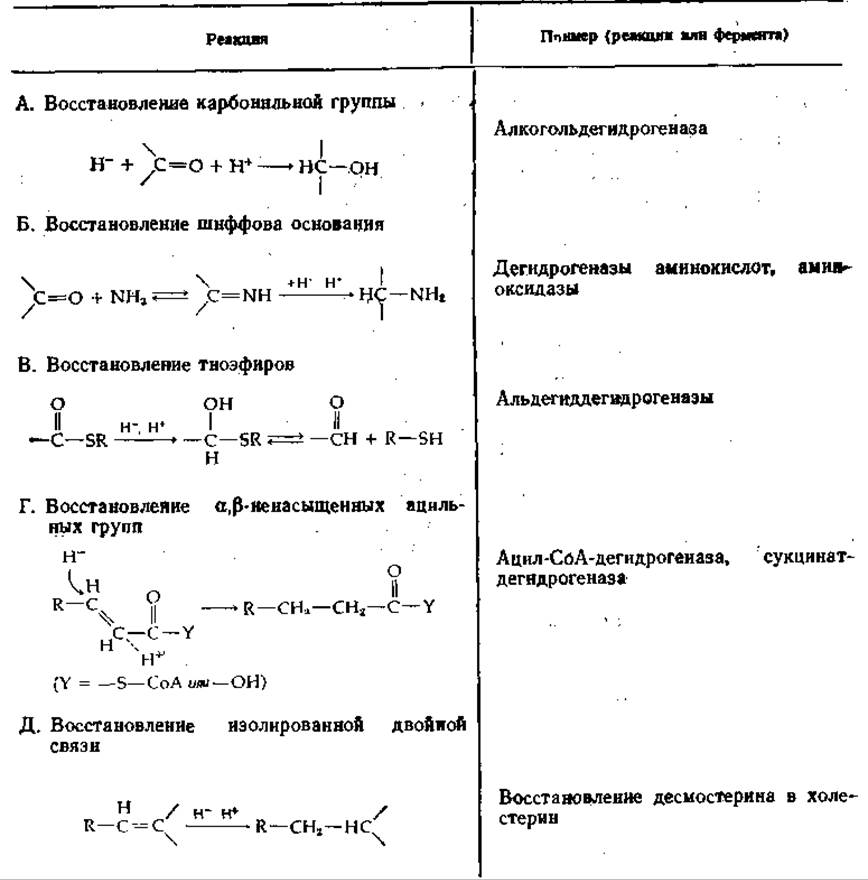
а Реакция типа 9 (см. табл. 9-1): гипотетический гидрид-ион Н- переносится иа субстрат от кофермента с подходящим окислительно-восстановительным потенциалом, такого, как NADH (DPNH), NADPH (TPNH), FADH, или восстановленный рибофлавии-5'-фосфат. Ферменты обычно именуют по обратным реакциям (т. е. по реакциям дегидрирования).
Почему существуют два пиридиновых нуклеотида NAD+ и NADP+, отличающихся только наличием или отсутствием дополнительного фосфата в нуклеотидной «ручке»? Ответ состоит, по-видимому, в том, что они участвуют в двух различных окислительно-восстановительных системах, хотя основанных на Никотинамиде, но действующих независимо друг от друга. Экспериментально определяемые отношения [NAD+]/[NADH+] и [NADP+]/[NADPH] заметно различаются. Таким образом, оказывается, что две системы действуют при различных окислительно-восстановительных потенциалах в одном и том же участке клетки. Что касается функции этих двух коферментов, то NAD+ чаще всего выступает в роли окислительного агента при отщеплении атома водорода от субстратов, в то время как NADP+ чаще восстанавливается до NADPH и играет роль восстановителя в биосинтетических процессах.