Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Организация метаболизма: катаболические пути
Брожение: «жизнь без кислорода»
Брожение, основанное на пути Эмбдена - Мейергофа
а. Гомоферментативное молочнокислое и спиртовое брожение
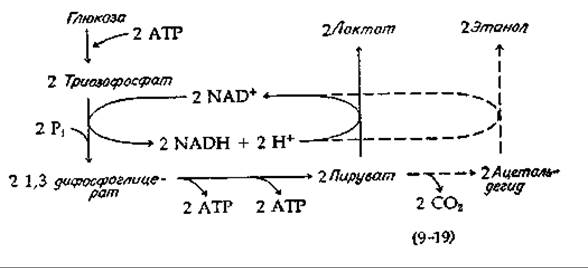
Мы уже кратко рассматривали (разд. Д, 1, б) процессы превращения глюкозы в лактат или, как это происходит в дрожжевых клетках, в этанол и СО2. Общая схема этих двух процессов брожения представлена в уравнении (9-19). Сплошные линии показывают превращение глюкозы в лактат, а штриховые соответствуют спиртовому брожению с превращением пирувата в этанол. Уравнение (9-19) иллюстрирует ряд особенностей, свойственных всем процессам брожения. NADH, образовавшийся на стадии окисления (левая часть уравнения), снова окисляется, восстанавливая субстрат в конечный продукт. NAD последовательно переходит в окисленную и восстановленную форму. Такое сопряжение стадий окисления и восстановления с точным соблюдением эквивалентности характерно для всех истинных (анаэробных) процессов брожения. Точно так же всем процессам брожения свойственно образование АТР из ADP и Pi путем субстратного фосфорилирования. Стехиометрия обычно очень проста. Например, согласно уравнению (9-10), на 1 моль сбраживаемой глюкозы приходится 2 моль образовавшегося АТР.
б. Энергетические соотношения
Если мы оставим в стороне синтез АТР, то для реакций, представленных на схеме (9-19), получим уравнения (9-20) и (9-21). Отметим, что изменения в свободной энергии оказываются отрицательными и имеют достаточно большую величину, чтобы реакции шли практически до полного завершения. Однако процесс брожения сопряжен с синтезом двух молекул АТР из ADP и неорганического фосфата, а для этой реакции [уравнение (9-22)] ∆G' является большой положительной величиной:
Чтобы определить суммарное изменение свободной энергии, мы должны к значениям ∆G' для уравнений (9-20) и (9-21) добавить 2∙34,5 = +69,0 кДж. Когда мы это сделаем, то увидим, что изменение свободной энергии все равно остается существенно отрицательным, так что реакции должны пройти полностью и, следовательно, брожение вполне может использоваться организмами для получения энергии.
Биохимики часто подсчитывают энергетическую «эффективность» процесса, для чего относят ∆G синтеза АТР, идущего сопряженно с рассматриваемым процессом (в данном случае +69 кДж), к понижению свободной энергии для процесса, не сопряженного с синтезом АТР (196 или 235 кДж∙моль-1). В данном случае эффективность характеризует сопряжение уравнения (9-22) (для 2 моль АТР) с уравнениями (9-20) и (9-21) и получается равной 35 и 29% соответственно. Согласно этому расчету, природа лишь треть свободной энергии метаболизма использует для синтеза АТР. Однако надо ясно отдавать себе отчет в том, что такой подсчет «эффективности» с термодинамической точки зрения не имеет строго определенного значения. Кроме того, клетка затем расходует АТР (для различных целей) далеко не со 100%-ной эффективностью.
Чем объяснить столь большое понижение свободной энергии в процессах, описываемых уравнениями (9-20) и (9-21)? Общего окисления при этом не происходит, наблюдается только перераспределение ранее существовавших связей между атомами субстрата. Почему же это перераспределение дает столь большое по величине отрицательное значение ∆G? Чтобы получить ответ, следует проанализировать число связей каждого типа в субстрате и в продуктах. В ходе превращения глюкозы в две молекулы лактата исчезает одна связь С—С, одна связь С—О и одна связь О—Н, и образуется одна новая связь С—Н и одна связь С = О. Если мы просуммируем энергии этих связей (табл. 3-6), то получим, что разность ∆Н при переходе от субстрата к продуктам составляет всего около 20 кДж∙моль-1. Однако молочная кислота содержит карбоксильную группу, а карбоксильные группы приобретают особенно большую устойчивость вследствие резонанса. Дополнительная резонансная энергия карбоксильной группы (табл. 3-6) равна 117 кДж (28 ккал) на 1 моль, или 234 кДж/моль для двух карбоксильных групп. Это значение очень близко к изменению свободной энергии [уравнение (9-20)], которое получается при сбраживании глюкозы в лактат. Таким образом, освобождающаяся энергия в основном определяется перераспределением связей, приводящим к образованию карбоксильной группы лактата. Резонансная стабилизация СО2, которую Полинг оценил равной 151 кДж/моль, такова, что делает понятным значение ∆G при спиртовом брожении [уравнение (9-21)].
Теперь сформулируем общее правило, согласно которому брожение может осуществляться в том случае, когда субстраты, состоящие преимущественно из атомов, связанных одинарными связями, а также таких групп, как карбонильная, с довольно слабой резонансной стабилизацией, превращаются в продукты, содержащие карбоксильные группы, или в СО2. Принимая эффективность равной 30%, получим, что на каждую вновь образованную карбоксильную группу или молекулу СО2 освобождается энергия, как раз достаточная для синтеза одной молекулы АТР. Следует, однако, иметь в виду, что для образования АТР должен еще существовать специальный механизм. Интересно отметить, что синтез АТР в большинстве случаев непосредственно связан с теми же химическими процессами, в результате которых при брожении образуются карбоксильные группы или молекулы СО2. Наиболее важной реакцией является окисление альдегидной группы глицеральдегид-3-фосфата в карбоксильную группу 3-фосфоглицерата (рис. 8-13).
Сравним сбраживание глюкозы с ее полным окислением в двуокись углерода и воду [уравнение (9-23)], т. е. с процессом, который дрожжевые клетки (а также наши собственные клетки) осуществляют при наличии кислорода:
![]()
Общее изменение свободной энергии более чем в 10 раз выше, чем при брожении; это позволяет клеткам вырабатывать во много раз большее количество АТР. Выход АТР в результате реакции (9-23), составляет 38 моль АТР — в 19 раз больше, чем при сбраживании глюкозы. Таким образом, наблюдение Пастера, показавшее, что дрожжи на воздухе перерабатывают гораздо меньше сахара, чем в отсутствие воздуха, получает вполне понятное объяснение. Одновременно становится ясно, почему в анаэробных условиях клетки должны метаболизировать огромные количества субстрата (напомним, что говорилось в гл. 3, разд. Г, 1: для производства 10 г клеток требуется энергия ~1 моль АТР).
в. Варианты спиртового и гомоферментативного молочнокислого брожения
Ход брожения часто сильно меняется в зависимости от конкретных условий. На рис. 9-9 приведен целый ряд дополнительных метаболических путей. Мы уже рассматривали превращение глюкозы в триозофосфат и далее через путь а в пируват, а затем через путь в в лактат или через путь г в этанол.
Если в культуру бродящих дрожжей добавить бисульфит, то ацетальдегид, образующийся в реакции г, исключается из последующего процесса, образуя бисульфитный аддукт; тем самым блокируется восстановление ацетальдегида в этанол — реакция, необходимая для брожения в соответствии с уравнением (9-21). Дрожжевые клетки приспосабливаются к этим условиям, используя накапливающийся NADH для восстановления половины образующегося триозофосфата в глицерин по пути б. Для такого процесса необходимы два фермента, дегидрогеназа и фосфатаза, гидролитически отщепляющая фосфат. Суммарная реакция описывается уравнением
![]()
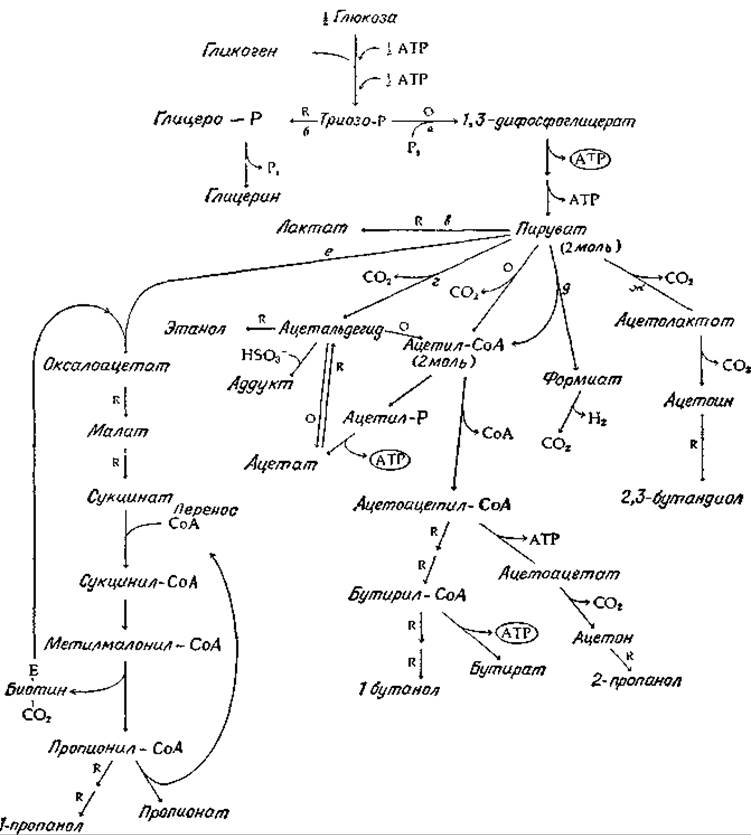
РИС. 9-9. Последовательности реакций брожения, основанного на пути Эмбдена — Мейергофа. Окислительные стадии (с образованием NADH) обозначены через «О», восстановятельные (с использованием NADH) — через «R».
Отметим, что при этом образуется одна молекула СО2 и что общее понижение свободной энергии вполне достаточно, чтобы сделать реакцию в высокой степени самопроизвольной. Однако (снова обращаясь к рис. 9-9) можно заметить, что суммарное количество синтезированного АТР теперь становится равным нулю. Такое брожение, очевидно, не может обеспечить рост клеток; его используют, однако, в промышленности для получения глицерина.
Сходный вариант спиртового брожения наблюдается, когда дрожжи выращиваются в щелочной среде. В этих условиях ацетальдегид окисляется NAD+-зависимой дегидрогеназой в ацетат. Образовавшийся на этой стадии NADH используется для восстановления эквивалентного количества ацетальдегида в этанол. Одновременно NADH, образовавшийся при окислении триозофосфата, используется для восстановления половины образовавшихся молекул триозофосфата в глицерофосфат. Суммарная реакция описывается уравнением
![]()
Такая реакция оказывается благоприятной для клетки, поскольку образующаяся уксусная кислота нейтрализует щелочь; pH среды смещается к нейтральным значениям, после чего вновь возобновляется стандартный процесс спиртового брожения. Суммарное значение ∆G' оказывается столь значительным, что может обеспечить синтез двух или трех молекул АТР, однако неизвестно, где и каким образом это происходит. Очевидно, наиболее логичным было бы его сопряжение с окислением ацетальдегида в ацетат, которое могло бы идти через образование ацетил-СоА и ацетилфосфата (рис. 9-9) — путь, используемый во многих процессах бактериального брожения. Однако дрожжи содержат фермент, окисляющий ацетальдегид непосредственно в ацетат, причем сопряженного синтеза АТР при этом не было выявлено.
Восстановление диоксиацетонфосфата в глицерофосфат происходит также в летательных мышцах насекомых; по-видимому, оно представляет путь, альтернативный образованию в этих тканях молочной кислоты. Хотя превращение свободной глюкозы в глицерофосфат и пируват не дает в итоге прироста АТР, следует учесть, что в мышцах исходным материалом служит гликоген, который по сравнению со свободной глюкозой требует для затравочных реакций вдвое меньше АТР. Кроме того, дисмутация триозофосфата, приводящая к образованию глицерофосфата и пирувата, может обеспечить быструю наработку АТР при интенсивных сокращениях мощной летательной мышцы насекомого. Во-время более медленной восстановительной фазы глицерофосфат, как полагают, снова окисляется, поступая в митохондрии этих в высокой степени аэробных клеток. Таким образом, транспортировка глицерофосфата в митохондрии служит средством доставки в митохондрии восстановительных эквивалентов, полученных от NADH. Возможно поэтому, что значение глицерофосфата для мышечного метаболизма связано в основном с его транспортной функцией, а не с участием в быстром образовании АТР.