Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Генетические методы
Генетика эукариотических организмов
Если в быстро растущей бактерии синтез ДНК происходит практически непрерывно, то в эукариотических клетках репликация занимает значительно более ограниченную часть клеточного цикла [167]. В клетках млекопитающих собственно митоз занимает обычно около 1 ч (рис. 15-25). За ним следует «пауза», обозначаемая G1, продолжительность которой может сильно меняться в зависимости от снабжения клетки питательными веществами, а также от других факторов. Обычно эта «пауза» составляет приблизительно 10 ч. Во время фазы S (занимающей около 9 ч) активно происходит репликация ДНК. Далее наступает вторая «пауза» (G2), продолжающаяся 4 ч при общей 24-часовой продолжительности клеточного цикла (рис. 15-25). Следует иметь в виду, что продолжительность отдельных этапов клеточного цикла сильно отличается у разных организмов. Все сказанное выше относится к быстро растущим культурам, где для всех, или по крайней мере для большинства, клеток характерен одинаковый цикл. Особенность клеток взрослого организма состоит в том, что деление большинства из них в течение большей части времени ингибировано. Это обстоятельство послужило основанием для ряда критических замечаний в адрес концепции клеточного цикла [168].
Прежде чем перейти к рассмотрению генетики высших организмов, напомним вкратце некоторые сведения о процессах клеточного деления, известных под названием митоз и мейоз.
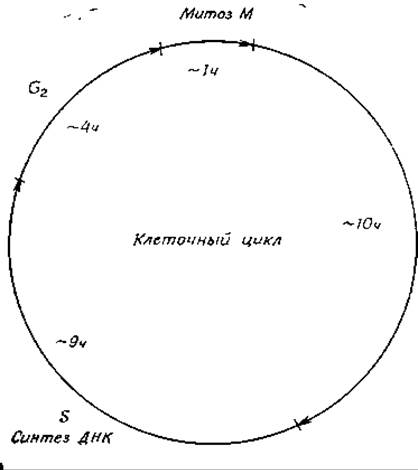
РИС. 15-25. Клеточный цикл. Указанные времена характерны для клеток млекопитающих. Для клеток других организмов они могут быть совсем другими. Для обозначения периода G1+S+G2 используют также термин интерфаза.
а. Митоз
Распределение хромосом между дочерними клетками при делении соматических клеток осуществляется путем митоза (гл. 1, разд. В,3). Последовательные фазы митоза называются профазой, метафазой, анафазой и телофазой (рис. 15-26). При конденсации хромосом во время профазы можно видеть, что они действительно состоят из двух отдельных нитей, переплетенных друг с другом. Эти нити называются хроматидами. Каждая хроматида представляет собой одну из двух идентичных двухцепочечных молекул ДНК (или группы молекул), образованных в процессе репликации ДНК, т. е. во время фазы S клеточного цикла. По мере спирализации хромосом (во время профазы) ядерная оболочка полностью фрагментируется или растворяется.
Важным событием, предшествующим основным стадиям митоза, является возникновение в клетке полюсов. В клетках животных полюсы образуются центриолями, которые расходятся в противоположных направлениях и занимают положения на противоположных сторонах клетки. Каждую из центриолей сопровождает более мелкая «дочерняя» центриоль, располагающаяся под прямым углом по отношению к родительской. В клетках растений, где нет центриолей, границы полюсов фиксированы не столь четко. По мере того как клетка готовится к митозу, можно наблюдать появление тонких микротрубочек (диаметром около 15 нм), расходящихся в радиальных направлениях от полюсов. К концу профазы микротрубочки проходят расстояние от одного полюса до другого, образуя так называемое веретено. Они также соединены с центромерами хромосом.
В метафазе хромосомы выстраиваются в центре клетки, образуя метафазную пластину, после чего центромера разделяется, и сестринские хроматиды в результате полностью отделяются друг от друга. В анафазе разделенные хроматиды, которые теперь уже называются дочерними хромосомами, движутся к противоположным полюсам так, как будто бы они растаскиваются в результате сокращения волокон веретена. Механизм, лежащий в основе перемещения хромосом, еще не раскрыт.
В последней фазе деления клетки — телофазе, во время которой вокруг каждого набора дочерних хромосом образуются новые ядерные оболочки, клетка либо делится на две, либо (в случае растений) в центре клетки образуются новые плазматические мембраны и клеточная стенка.
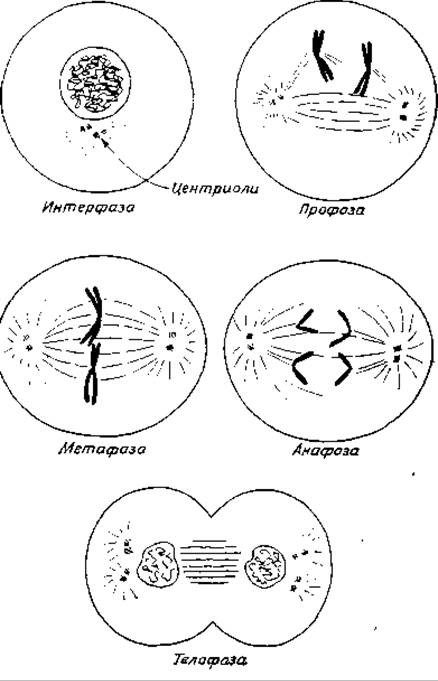
РИС. 15-26. Митоз. На рисунке показана схема митотического деления клетки с одной гомологичной парой хромосом (Mazia D., Sсi. Am., 205, 101—120, Sept. 1961).
б. Мейоз
Механизм, при помощи которого хромосомы распределяются в половых клетках (гаметах), например при формировании яйцеклетки и сперматозоидов, называется мейозом (гл. 1, разд. В, 3). При образовании гамет число хромосом в клетке уменьшается вдвое, причем в каждую из гамет попадает лишь одна хромосома из каждой гомологичной пары. О генах, локализованных в одной хромосоме, говорят, что они сцеплены, поскольку обычно они передаются потомству все вместе, в виде единого набора. Гены же, локализованные в разных хромосомах, не сцеплены друг с другом, и их наследование характеризуется случайным расщеплением, установленным еще в знаменитых исследованиях Менделя.
Простого факта, что генетический материал упакован в виде обособленных частиц (хромосом), в принципе уже достаточно для того, чтобы обеспечить возможность значительного перераспределения генетической информации между разными индивидуумами при половом размножении. Заметим, однако, что изменениям в пределах самих хромосом это отнюдь не способствует. Перераспределение генетической информации внутри хромосом происходит путем генетической рекомбинации в процессе кроссинговера. Эта особенность мейоза имеет чрезвычайно важное биологическое значение. В фазе S, предшествующей мейозу, ДНК удваивается точно так же, как и перед митозом. В результате генетического материала оказывается достаточно для образования четырех гаплоидных клеток. Мейоз состоит из двух последовательных клеточных делений (рис. 15-27). Кроссинговер происходит перед первым делением на стадии четырех нитей. Две гомологичные хромосомы объединяются, образуя бивалент (или тетраду), состоящий из четырех хроматид. В точках, называемых хиазмами, каждая хроматида вступает в тесный контакт с хроматидой другой гомологичной хромосомы. Во время метафазы первого мейотического деления гомологичные хромосомы (каждая из которых по-прежнему все еще содержит две хроматиды) расходятся. Каждая хроматида теперь несет некоторую генетическую информацию, находившуюся ранее в другом члене гомологичной пары, и наоборот (рис. 15-27). Затем без дальнейшей репликации ДНК происходит второе мейотическое деление, при котором хроматиды расходятся, образуя гаплоидные клетки.
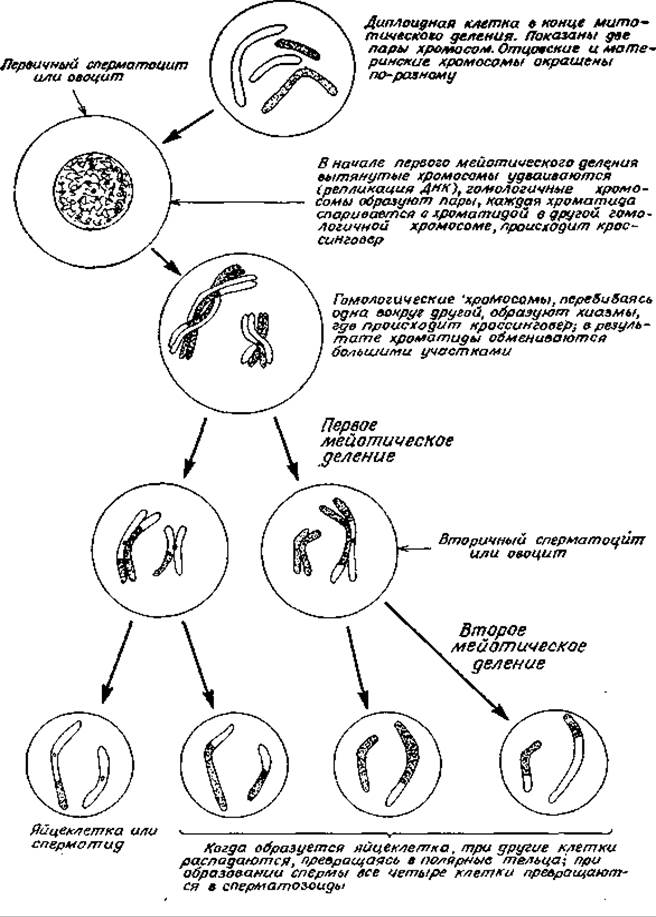
РИС. 15-27. Мейоз. Деление клетки, приводящее к образованию гаплоидных гамет.
В процессе кроссинговера гены, сцепленные в одной хромосоме, могут разделяться. При этом распределение генетических признаков в потомстве не будет подчиняться предсказанному теорией Менделя. Кроссинговер впервые достаточно полно исследовал Морган на плодовой мушке Drosophila melanogaster. При составлении первых генетических карт исходили из предположения, что частота кроссинговера непосредственно зависит от линейного расстояния между генами в хромосоме. Таким образом, мы видим, что основная идея, лежащая в основе описанного выше метода составления генетических карт Е. coli по результатам измерения частоты различных рекомбинаций, была использована еще раньше при изучении кроссинговера в хромосомах дрозофилы. Для четырех хромосом дрозофилы были составлены детальные генетические карты, включающие большое число мутаций. Сходные методы были также использованы при изучении многих других организмов, в том числе кукурузы, дрожжей и грибов типа Neurospora crassa и Aspergillus nidulans.
Важное преимущество грибов с точки зрения их использования для генетических исследований состоит в том, что, подобно прокариотам, они на протяжении большей части жизненного цикла сохраняют гаплоидный набор хромосом. Это позволяет легко выявить биохимические дефекты, связанные, в частности, с нарушением синтеза определенных, необходимых для их существования соединений. В то же время грибы можно скрещивать и определять частоту кроссинговеров, используя эти данные для составления генетических карт. Именно поэтому изучение ауксотрофов нейроспоры, начатое в 1940 г. Бидлом и Татумом, обычно считают началом биохимической генетики. Явление рекомбинации у бактерий было открыто Ледербергом несколькими годами позже.
в. Политенные хромосомы
Большинство клеток высших организмов обычно имеет диплоидный набор хромосом, однако в некоторых из них набор хромосом может быть удвоен или увеличен в еще большее число раз. Клетка, в которой число хромосом увеличено по сравнению с диплоидным в два раза, называется тетраплоидной, а в большее число раз — полиплоидной. Селекционерам удалось получить много разновидностей тетраплоидных цветковых растений, размеры которых, как правило, больше диплоидных, Большинство клеток нашего организма также диплоидные, однако и у нас имеются полиплоидные клетки. Некоторые из них, например, обнаруживаются в печени. Наиболее выразительным примером увеличения содержания ДНК в клетке могут служить гигантские политенные хромосомы личинки двукрылых. ДНК клеток слюнных желез и некоторых других частей этих личинок может удваиваться без деления клетки приблизительно в 13 раз, причем количество ДНК может возрастать при этом в несколько тысяч раз (например, в 213 раз). Сусперспирализованные удвоенные молекулы ДНК располагаются рядом друг с другом в более вытянутой форме, чем в обычных хромосомах. Общая длина четырех гигантских хромосом дрозофилы составляет приблизительно 2 мм, тогда как в обычной диплоидной клетке их длина равна ~7,5 мкм. Гигантские хромосомы имеют поперечнополосатую структуру; по всей длине хромосомы можно видеть приблизительно 3000 поперечных дисков. Поскольку было установлено наличие корреляции между видимыми изменениями этих дисков и конкретным и мутациями в ДНК, изучение политенных хромосом стало вторым важным методом картирования генов в хромосомах плодовой мушки. Генетические карты, полученные обоими методами, хорошо согласуются друг с другом.
г. Картирование хромосом человека
До недавнего времени мало было известно о локализации генов в хромосомах человека. Исключение составляли лишь признаки, сцепленные с полом (гл. 1, разд. В, 4), которые могут быть локализованы в Х-хромосомах. Ряд исследований, проведенных в последнее время, ознаменовались успехами и привели к систематическому картированию большого количества генов человека [169—171]. Наиболее важным оказался при этом метод слияния соматических клеток (дополнение 15-Д). Для слияния человеческих лимфоцитов с клетками грызунов часто используют инактивированный вирус Сендай, обладающий способностью вызывать сначала адгезию, а затем слияние клеток. Из гибридных клеток, полученных в результате слияния человеческих клеток с клетками мыши или хомяка, можно получить линии клеток, ядра в которых также сливаются. Хотя такие клетки могут размножаться, давая много поколений, тем не менее они склонны утрачивать три этом хромосомы, особенно те из них, которые ведут свое происхождение от клеток человека. Наблюдая за утратой определенных биохимических признаков, например некоторых ферментов, специфических для человека (которые могут быть отделены от ферментов хомяка методом электрофореза), можно установить наличие или отсутствие определенного гена в данной хромосоме. Очевидно, что для этого необходимо одновременно следить за потерей хромосом на каждой стадии эксперимента. Новые методы окрашивания дозволяют идентифицировать каждую из 26 пар хромосом человека. В настоящее время разрабатываются методы точного генетического картирования применительно к культуре клеток [171].
Дополнение 15-Д
Гаплоидные растения и слияние клеток
Недавно разработанные методы, позволяющие получать целые растения из единичных клеток, а также осуществлять слияние растительных клеток, могут иметь революционизирующее значение для селекции растений. Они могут послужить также основой нового метода изучения фенотипического выражения генов у растений. Так, например, из гаплоидных ядер пыльцевых зерен удалось вырастить целые гаплоидные растенияа. Поскольку клетки гаплоидных растений содержат, по-видимому, только по одной копии большого числа генов, то в таких растениях легко обнаружить мутации, вызванные облучением или химическими агентами, что в свою очередь может способствовать значительному ускорению селекционных работ.
В другой серии экспериментов дифференцированные, содержащие хлорофилл мезофильные клетки листьев табака (Nicotiana) обрабатывали для удаления клеточной стенки ферментами, разрушающими целлюлозу и пектин. Затем вызывали слияние образующихся протопластов с протопластами других видов табака, получая в результате гибриды, образованные неполовым путем6. Хотя на пути к практическому применению этого метода придется преодолеть многие препятствия, тем не менее с его помощью, по-видимому, можно будет получить большое число новых растений.
а Nitsch J. Р., Z. Pflanzenzüecht, 67, 3—18 (1972).
б Carlson Р. S., Smith Н. Н., Dearing R. D., PNAS, 69, 2292—2294 (1972).
д. Цитоплазматическая наследственность
Не все наследуемые признаки подчиняются закону Менделя, относящемуся к генам, локализованным в хромосомах. Некоторые признаки наследуются непосредственно от материнской клетки так, как будто соответствующие гены находятся не в ядре, а в цитоплазме [172]. Примером может служить Chlamydomonas (рис. 1-9) с цитоплазматической локализацией некоторых мутаций, обеспечивающих устойчивость к стрептомицину. Известно еще много других примеров для большого числа организмов. Один из цитоплазматических генов вызывает «мужскую стерильность» кукурузы. Материнской цитоплазмой переносится ген, предотвращающий образование у растения жизнеспособных зрелых пыльцевых зерен. Были обнаружены, однако, мутации генов, локализованных в ядрах, нейтрализующие описанный выше эффект и восстанавливающие плодовитость [173]. Эти мутации были эффективно использованы для получения гибридных семян кукурузы. У материнских растений с цитоплазматическим геном мужской стерильности нет необходимости «удалять метелки» для предотвращения самоопыления. Если такие растения опылить пыльцой другой линии, ядра клеток которой несут восстанавливающий тен, то образующиеся гибридные семена будут давать начало самооплодотворяющимся растениям, необходимым для получения урожая. К сожалению, мутантный ген цитоплазматической мужской стерильности делает растение крайне восприимчивым к определенному типу грибов Helminthosporium maydis, вызывающих южный гельминтоспориоз кукурузы. В 1970 г. в сельском хозяйстве США сложилось почти катастрофическое положение из-за того, что это заболевание поразило обширные районы страны. В связи с этим использование таких линий было практически прекращено.
В каком месте клетки находятся цитоплазматические гены? Известно три места их локализации: митохондрия, хлоропласты и некоторые участки, связанные с мембранами [174, 175]. Примером последнего могут служить клетки штаммов-убийц у дрожжей. Клетки, содержащие признак «убийц», выделяют токсин, убивающий чувствительные по отношению к нему клетки, в то время как сами устойчивы к этому токсину. Соответствующие гены переносятся при помощи не ДНК, а двухцепочечной РНК, причем они чем-то напоминают колициногенные факторы кишечных бактерий. Сходные частицы (k-факторы) обнаруживаются у Paramecium [176].
Митохондриальная ДНК как переносчик цитоплазматической наследственности изучена наиболее полно [177—179]. В клетках животных митохондриальная ДНК представлена кольцевыми двухцепочечными молекулами, длина которых составляет приблизительно 5 мкм (мол. вес 107), что соответствует приблизительно 15 000 парам оснований с информационной емкостью, включающей приблизительно 15 генов. Молекулы митохондриальной ДНК Tetrahymena имеют несколько большие размеры (длина их окружности составляет приблизительно 15 мкм), а в случае растений эти размеры могут быть еще большими. Размер кольцевых молекул митохондриальной ДНК дрожжей составляет 25—26 мкм. Существуют убедительные доводы в пользу того, что митохондриальная ДНК детерминирует специфическую рибосомную РНК митохондрии. Митохондриальная ДНК детерминирует также несколько типов молекул тРНК. У животных 20—25% митохондриального генома, по-видимому, участвует в выработке молекул рРНК и тРНК.
Веские доводы, свидетельствующие о том, что какая-то часть остальных генов митохондриальной ДНК детерминирует синтез белков, необходимых для функционирования митохондрий, были получены в опытах с так называемыми petite-мутантами дрожжей. Эти спонтанно образующиеся мутанты легче всего могут быть получены при обработке дрожжевых клеток высокими концентрациями интеркалирующих агентов типа этидиумбромида (рис. 2-27). Длительная обработка такими соединениями вызывает практически полный распад митохондриальной ДНК и образование мутантов, вырастающих лишь до небольших размеров и практически полностью лишенных митохондрий. Поскольку дрожжи способны расти в анаэробных условиях (используя энергию, освобождающуюся при брожении), такие мутантные клетки могут оказаться жизнеспособными. Несмотря на то что большая часть митохондриальных белков синтезируется под контролем ядерных генов, потеря ДНК, вызванная этидиумбромидом, приводит либо к полному исчезновению митохондрий, либо к образованию митохондрий, лишенных цитохромов — компонентов цепи переноса электронов. Таким образом, митохондриальная ДНК несет, очевидно, какую-то важную информацию. Внутримитохондриальные гены детерминируют синтез нескольких белков внутренней мембраны митохондрий. Три из них — субъединицы цитохромоксидазного комплекса, в состав которого входят также четыре субъединицы, синтезируемые в цитоплазме [179]. Четыре гидрофобных белковых субъединицы внутренней мембраны митохондрий, синтезируемые митохондриальными рибосомами, связаны с F1-АТРазным комплексом (гл. 10, разд. Д, 8).
ДНК хлоропластов приблизительно в 10 раз больше, чем митохондриальная ДНК животных (их мол. вес составляет приблизительно 1 ∙108) [179а]. Она способна детерминировать синтез примерно 150 белков. В каждом хлоропласте может быть от 10 до 100 копий [180]. Так же как и ДНК митохондрий, ДНК хлоропластов детерминирует, по-видимому, синтез молекул рибосомной и транспортной РНК. Установлено также, что информация о синтезе основной субъединицы (мол. вес которой равен приблизительно 55 000) рнбулозодифосфат-карбоксилазы (гл. 7, разд. К, 3, ж) закодирована в ДНК хлоропластов [181, 182]. Синтез же меньшей субъединицы (мол. вес которой равен приблизительно 15 000) того же фермента закодирован в ядре. Несколько гидрофобных мембранных белков хлоропластов также синтезируются на рибосомах хлоропластов, используя мРНК, транскрибированную с хлоропластной ДНК. Существуют данные о том, что в хлоропластах Chlamydomonas содержатся некоторые гены, ответственные за синтез белков хлоропластных рибосом [183].
Этидиумбромид ингибирует репликацию также и ДНК хлоропластов и вызывает частичную деградацию уже имеющейся в хлоропластах ДНК, не влияя при этом на репликацию ДНК в ядре. Этот эффект сходен с описанным выше действием этидиумбромида на митохондриальную ДНК. Вместе с тем клетки Chlamydomonas, обработанные этидиумбромидом, способны в дальнейшем восстанавливать содержание ДНК в хлоропластах. При интерпретации этих данных было высказано предположение о существовании «исходных копий» хлоропластной ДНК в специально защищенных участках. При такой интерпретации необходимо учитывать также данные, свидетельствующие о том, что, хотя репликация ДНК в ядре и в других органеллах происходит в разные периоды клеточного цикла, соотношение между содержанием ДНК в ядре и органеллах поддерживается на постоянном уровне. Должен, по-видимому, существовать какой-то регуляторный механизм, обусловливающий сопряжение процессов репликации ДНК в ядре, митохондриях и хлоропластах [184].