Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Генетические методы
Умеренные бактериофаги. Фаг λ
Когда ДНК бактериофага проникает в бактериальную клетку, она обычно практически мгновенно начинает контролировать работу метаболического аппарата клетки и направляет его полностью на образование новых вирусных частиц. В результате приблизительно через 20 мин образуется 100—200 новых вирусных частиц, что приводит к лизису клетки и ее гибели. Принципиально отлично от этого ведут себя умеренные фаги. Проникнув в клетку, ДНК умеренного фага может репрессироваться и интегрироваться с бактериальным геномом точно так же, как фактор F (рис. 15-2). При этом он переходит в состояние профага и вступает в так называемую лизогенную фазу развития: репрессированная ДНК фага реплицируется как часть генома бактерии, не причиняя вреда клетке до тех пор, пока какой-нибудь фактор не снимет репрессию и не «активирует» интегрированный генетический материал. После этого происходят репликация фага и лизис бактерии. Умеренные фаги могут существовать так же, как плазмиды (например, фаг Р1).
Наиболее хорошо изученным умеренным фагом является фаг-лямбда, живущий в клетках Е. coli [156—158]. По своему строению фаг λ, для которого характерно наличие отростка, чем-то напоминает Т-четные фаги (дополнение 4-Д), однако его ДНК-геном имеет меньшие размеры: мол. вес ДНК фага λ составляет приблизительно 31∙106, что соответствует 46 500 парам оснований. В бактериальной клетке концы ДНК фага λ могут соединяться друг с другом, образуя замкнутую репликативную форму вируса. Во многих зараженных клетках (примерно в 30%) ДНК фага λ интегрируется с бактериальной хромосомой в определенном сайте, att λ, локализованном на карте хромосомы Е. coli в положении, соответствующем 17 мин. Интегрированная ДНК фага представляет собой линейный фрагмент, составляющий около 1,2% общей длины хромосомы Е. coli. Он реплицируется вместе с остальной частью хромосомы и в большинстве случаев остается незамеченным.
Интерес биохимиков к бактериофагу λ объясняется рядом причин. Наиболее важная из них состоит в том, что, изучая этот бактериофаг, можно было надеяться получить ответы на основные вопросы о регуляции транскрипции. Мы можем, например, спросить, как это получается, что большая часть генов профага λ может не проявляться на протяжении многих поколений, а затем при определенных условиях вновь запускать синтез активных вирусов. Небольшие размеры генома фага λ позволяют надеяться, что мы сможем достаточно точно понять его устройство1). Бактерия-хозяин Е. coli К12 также хорошо изучена с генетической точки зрения; к тому же у этих бактерий есть очень «удобные» amber-супрессоры, благодаря которым можно легко определить мутации у бактериофага. Более того, интегрированный профаг может подвергаться мутациям практически любого типа, в том числе и большим делениям, что позволяет исследовать комплементарность с другими штаммами этого вируса. Известно целое семейство Модифицированных дефектных фагов λ. Поскольку при исключении из бактериальной хромосомы профаг иногда захватывает соседние гены бактериальной хромосомы, удалось выделить группу трансдуцирующих фагов λ, т. е. фагов, несущих определенные гены бактериальной хромосомы и способных передавать эти гены таким бактериям, у которых их нет. Предположение о возможности подобного переноса генов в геномы растений и других высших организмов привлекло значительный интерес и вызвало возбужденные дебаты. Другим результатом изучения фага λ явился метод, позволяющий более точно картировать положения генов.
а. Контроль на уровне транскрипции
Ответ на вопрос о том, почему гены фага λ могут в течение определенного времени не проявлять себя, был дан после того, как был обнаружен репрессорный белок [159, 161]. Один короткий опeрон профага λ постоянно транскрибируется РНК-полимеразой Е. coli. Этот оперон содержит гены cI и rех. Как показано на рис. 15-22, считывание этих генов начинается с 1-цепей ДНК профага. Белок, кодируемый геном сI, играет роль репрессора. Репрессор представляет собой олигомер (чаще всего димер), мол. вес одной субъединицы в котором составляет 27 000. Этот белок связывается с двумя операторными участками ДНК профага. Один оператор (оL) расположен слева, а другой (oR) — справа от гена сI (рис. 15-22). Изучение фрагментов ДНК, защищаемых репрессором от воздействия нуклеазы, позволило сделать вывод, что на каждом операторе есть три субучастка, последовательно заполняемых шестью мономерами репрессора (слева направо для оL и справа налево для оR). Была расшифрована последовательность нуклеотидов в этой области, причем оказалось, что каждый из гипотетичных субучастков имеет ось приблизительной вращательной симметрии второго порядка (т. е. имеет место почти палиндромная последовательность). Каждый субучасток содержит 17 пар оснований, причем одна половина участка содержит последовательность TATCACCGC или очень похожую на нее, тогда как другая половина неcколько более изменчива. Возможно, что при связывании димерного репрессора с каждым из субучастков его мономеры находятся в квазиэквивалентных конформациях [159].
1) В настоящее время нуклеотидная последовательность фага λ полностью расшифрована.— Прим. ред.
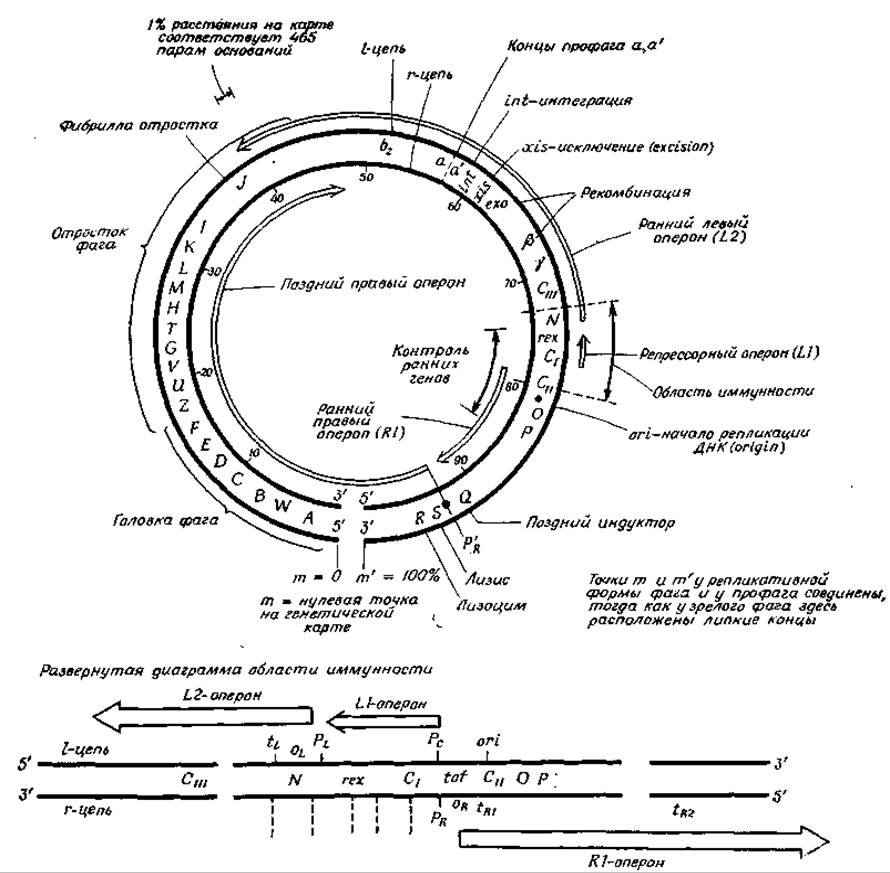
РИС. 15-22. Генетическая и физическая карта генома фага λ [156]. Более детальная диаграмма области иммунности приведена в работе Honigman A., Hu S-L., Chase R., Szybalski W., Nature (London), 262, 112—116 (1976).
Блокируя эти операторы, репрессор предотвращает синтез ферментов, необходимых для исключения ДНК фага λ, из бактериальной хромосомы, а также для репликации и транскрипции остальных генов. В действительности дело обстоит сложнее, поскольку, по-видимому, для установления исходного лизогенного состояния необходимы продукты генов раннего левого (сIII) и раннего правого (cII) оперонов, стимулирующих транскрипцию гена cI. Однажды «сработав», эти гены больше не функционируют, так как они никогда не транскрибируются.
Считают, что в клетке есть всего лишь несколько молекул репрессора фага λ. В обычном состоянии этого достаточно для того, чтобы поддерживать состояние профага. Вместе с тем ультрафиолетовое облучение бактерии (действующее, по-видимому, опосредовано, через подавление синтеза ДНК) приводит к инактивации репрессора и транскрипции других оперонов фага λ.
Транскрипция левого оперона начинается в точке pL. Продуктом первого гена N является белок, разрешающий продолжение транскрипции в точках tL и tB [161]. Этот белок неустойчив — время полужизни его молекул (t1/2) составляет приблизительно 2 мин [162]. Левосторонняя транскрипция идет через гены ехо и ß, принимающие участие в процессе рекомбинации, и ген xis, необходимый для исключения (excision) фаговой ДНК из хромосомы. При включении ДНК фага λ хромосома Е. coli разрывается в точках аа' (рис. 15-22) и ДНК включается сразу же справа от gal-оперона (рис. 15-1). Теперь транскрипция профага может продолжаться с точки а' на гены бактерии. Трансляция мРНК, транскрибированной с этого раннего левого оперона, приводит к появлению ферментов, необходимых для освобождения профага и образования кольцевой репликативной формы фаговой ДНК. Исключение ДНК из бактериальной хромосомы происходит также вблизи точки а', причем легко видеть, что при исключении фаг λ может иногда захватывать с собой соседние гены gal клетки-хозяина.
Продукт гена N делает возможной также и правостороннюю транскрипцию через гены О, Р и Q и далее уже с меньшей скоростью вдоль остальной хромосомы до точки а. Гены О и Р детерминируют синтез белков, позволяющих репликационной системе бактерии-хозяина начать образование новых молекул фаговой ДНК. Репликация начинается в точке ori и протекает в обоих направлениях, как это описано в разд. Д. Ген Q детерминирует синтез белка, который значительно ускоряет транскрипцию поздних генов, начиная с промотера PR.
Как показано на рис. 15-22, хромосома обычно подразделяется на четыре оперона: короткий — продуцирующий репрессор, ранний левый, ранний правый и поздний1). Ранние опероны детерминируют в основном синтез ферментов, обеспечивающих репликацию и рекомбинацию, а также синтез регуляторных белков. Поздний оперон связан с синтезом белков, необходимых для организации вирусных частиц; он должен транскрибироваться с более высокой скоростью, которая обеспечивается продуктом гена Q. В пределах позднего оперона гены от А до F участвуют в упаковке ДНК фага λ и в образовании головок, тогда как гены от z до j обеспечивают синтез и сборку отростков. Гены S и R продуцируют белки, вызывающие разрушение мембраны бактерии-хозяина и лизис клетки. На последних стадиях фазы литического развития большая часть ранних генов выключается другим репрессором фага λ (кодируемым геном crо). Из сказанного видно, что регуляция транскрипции даже у вирусов может представлять собой достаточно сложный процесс.
1) Несколько сходная организация генов обнаружена в Т-четном фаге, в фаге Т7 и в других бактериофагах.
б. «Липкие концы» молекул ДНК
Если репликативная форма ДНК фага λ замкнута в кольцо, то ДНК зрелых частиц имеет, как известно, линейную форму. В отличие от линейной ДНК Т-четных фагов ДНК фага λ при освобождении из вириона самопроизвольно образует либо кольца, либо линейные «агрегаты». Это свидетельствует о том, что ДНК фага λ имеет «липкие» концы, соединяющиеся друг с другом за счет специфического спаривания оснований. Непосредственное определение нуклеотидной последовательности подтвердило это предположение. На рис. 15-23 показана нуклеотидная последовательность вблизи точек m, m' (рис. 15-22), в которых происходит раскрыв репликативной формы ДНК, а также в липких концах l- и r-цепей. Считают, что кольцевая форма раскрывается под действием эндонуклеазы. Существование липких концов подтверждается не только определением нуклеотидных последовательностей. Оказалось, что две точки, в которых происходят гидролитические разрывы связей (на рис. 15-23 эти точки обозначены стрелками), разделены 12 парами нуклеотидов, образующими участок ДНК с поразительно высокой степенью симметрии [163, 164]. Таким образом, здесь мы опять сталкиваемся с палиндромом, образующим на сей раз специфический участок в молекуле ДНК.
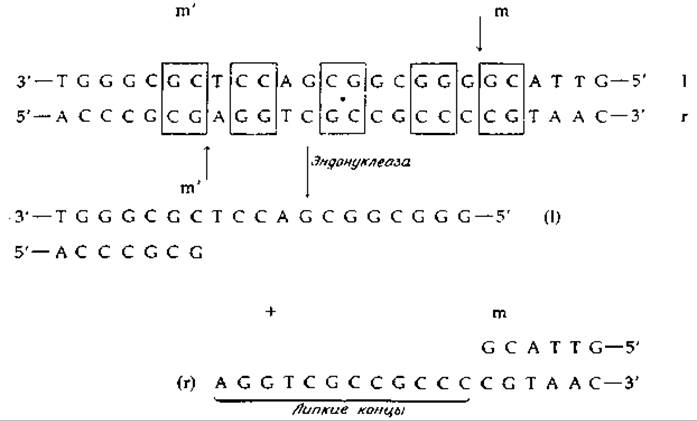
РИС. 15-23. Липкие концы ДНК фага и их образование из репликативной формы под действием эндонуклеазы. Обратите внимание на ось локальной приблизительной симметрии второго порядка (местоположение которой обозначено жирной точкой), которая служит специфическим участком взаимодействия с симметричным димерным ферментом. Симметрично расположенные пары оснований заключены в рамки. Точки mm' соответствуют этим точкам на генетической карте (рис. 15-22).
в. Гетеродуплексы и картирование генов физическими методами
Наличие фагов со значительными делециями в различных участках генома позволило разработать новый метод картирования генов с использованием непосредственных электронно-микроскопических наблюдений [165]. Сначала выделяют ДНК из двух различных штаммов фагов, например из дикого штамма типа X и из мутантного штамма с делениями определенного гена или генов. Полученную ДНК легко денатурировать, после чего r- и l-цепи можно разделить. Если l-цепи одного штамма смешать с r-цепями другого штамма и подвергнуть их «отжигу», то будет наблюдаться образование двухцепочечной ДНК. Поскольку, однако, в одном штамме имеется делеция, гомологичная область нормальной ДНК фага λ образует одноцепочечную петлю, которую можно легко увидеть при помощи электронного микроскопа. На рис. 15-24 в качестве примера показана электронная микрофотография такой гетеродуплексной молекулы с делеционной петлей. На этой фотографии виден также «пузырь» («bubble»), образованный в том месте, где в одну из нитей был включен фрагмент негомологичной ДНК[165]. Поскольку на электронных микрофотографиях можно достаточно точно измерить расстояния, этим путем можно получать точные «физические карты». Хромосомная карта, показанная на рис. 15-22, является такой «физической картой», и поэтому приведенные на ней расстояния более точны, чем на генетической карте Е. coli, приведенной на рис. 15-1. Описанный метод был использован также для исследования колициногенных факторов [166].
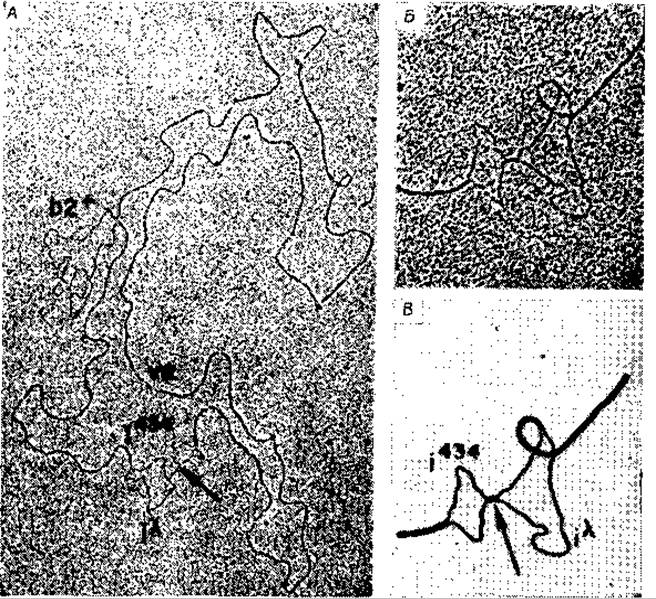
РИС. 15-24. А. Электронная микрофотография гетеродуплексной молекулы ДНК, образованной из комплементарных нитей фагов λb2 и λimm 434. В фаге λb2 участок ДНК фага X образует делеционную петлю (обозначена b2), а в фаге λimm 434 часть ДНК замещена на ДНК фага λ, в результате чего образуется «пузырь негомологичности» (обозначен і 434/іλ). Липкие концы ДНК обозначены v. е. Б. Увеличение изображения пузыря негомологнчности. В. Рисунок, поясняющий изображение, приведенное на рис. Б. Стрелкой показана короткая (20—150 нуклеотидов) гомологичная область (Westmoreland В. С. et al., Science, 163, 1343—1348, 1969).