Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Рекомбинация, интеграция и исключение
Механизмы рекомбинации
Рассмотрим теперь вкратце не совсем понятные химические явления, лежащие в основе таких явлений, как генетическая рекомбинация, интеграция вирусной ДНК с геномом клетки-хозяина и исключение профага из хромосомы клетки-хозяина. О сложности процесса рекомбинации свидетельствует тот факт, что у мутантов, дефектных по способности к рекомбинации, мутации локализуются не в одном, а в нескольких участках (генах) хромосомы Е. coli; соответствующие гены обозначаются через rесА, В, С, F, G и Н. Бактерии с мутациями в некоторых из этих генов необычайно чувствительны к ультрафиолетовому облучению, что свидетельствует об их неспособности репарировать (восстанавливать) повреждения ДНК, вызванные действием ультрафиолета (гл. 13, разд. Г, 2). Из этого следует, что некоторые из ферментов, обеспечивающих процесс рекомбинации, нужны клетке также и для восстановления повреждений, вызванных действием ультрафиолетового излучения. Однако специфические функции большинства продуктов этих генов все еще до конца не выяснены. Считают, что у Е. coli имеются две полноценные системы общей рекомбинации. В геноме фага λ имеются гены, кодирующие другую рекомбинационную систему, функционирующую независимо от продуктов генов фага λ, inf и xis (рис. 15-15), необходимых для интеграции и исключения генетического материала вируса и обеспечивающих процессы сайт-специфической (для определенных участков геномов) рекомбинации между генами клетки-хозяина и вируса.
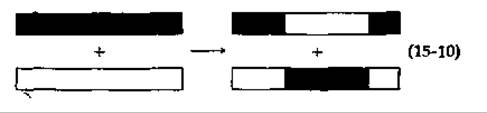
Наиболее непонятным в процессе рекомбинации является вопрос o том, каким образом объединяются гомологичные участки двух различных двухцепочечных молекул ДНК. Как схематически показано в уравнении (15-10), обмен участками полинуклеотидных цепей должен происходить точно в одной и той же точке каждой из двухцепочечных молекул.
В основе одного из первых механизмов, предложенных для объяснения генетической рекомбинации, лежало предположение, что рекомбинация непосредственно связана с синтезом ДНК. Согласно этому механизму «выбора копии», репликация протекает вдоль одной из цепей ДНК до какой-то случайной точки, в которой полимераза перескакивает на вторую из двух гомологичных хромосом и начинает копировать ее. Согласно этому механизму, вновь образованная молекула ДНК будет частично комплементарна одной родительской двухцепочечной молекуле ДНК, а частично — другой. Чтобы проверить правильность этого предположения, Меселсон и Вейгле (220] заражали Е. coli двумя штаммами фага λ, содержащими ДНК, меченную стабильными изотопами соответственно углерода (13С) и азота (15N). Центрифугирование в градиенте плотности показало, что рекомбинантная ДНК содержала как 13С, так и 15N. Таким образом, стало ясно, что в рекомбинантную ДНК потомства включается ДНК обоих родителей. Этот результат не подтвердил гипотезы выбора копии и свидетельствовал в пользу механизма, предполагающего, что рекомбинация сопровождается расщеплением цепей.
Если рекомбинация осуществляется путем ферментативного расщепления двух гомологичных двухцепочечных молекул ДНК (с последующим воссоединением), то возникает вопрос: каким образом удается при этом избежать инактивации генов за счет добавления или выпадения генетического материала? Представляется невероятным, чтобы рекомбинация могла происходить за счет случайного действия неспецифических ферментов и случайных воссоединений. Вместе с тем, как показывает опыт, общая рекомбинация может происходить в любой точке генома с достаточно постоянной частотой по всей длине цепи ДНК. Очевидно, что эти факты можно понять, только исходя из возможности комплементарного спаривания оснований гомологичных участков единичных цепей двух разных двухцепочечных молекул ДНК.
В основу одной из моделей рекомбинации были положены данные, полученные при изучении фагов λ и Т4. Согласно этой модели, ген ехо фага λ (рис. 15-22) не нужен для репликации, но необходим для общей рекомбинации. Продуктом этого гена является, как это было показано, 5'-3'-экзонуклеаза. Возможный механизм действия этого фермента в процессе рекомбинации показан на рис. 15-31. Процесс начинается действием эндонуклеазы, осуществляющей одноцепочечные разрывы в произвольных местах двухцепочечных молекул ДНК. Затем вступает в действие специальная экзонуклеаза, которая расширяет эти разрывы, превращает их в незаполненные промежутки. Оставшиеся при этом «открытыми» гомологические участки одних молекул будут стремиться присоединить комплементарные участки других молекул (рис. 15-31, стадия б) и образовывать Н-образные гетеродуплексные структуры. Перемещение точки ветвления (рис. 15-31, стадия в) приведет к удлинению гетеродуплексного участка и появлению короткой ветви. В случае реплицирующего фага Т4 были получены электронные микрофотографии [221] разветвленных молекул ДНК такого типа, как показанные на рис. 15-29. В результате действия эндонуклеазы на разветвленные структуры (рис. 15-31, стадия г) будут образовываться «надрезы». Любые одноцепочечные промежутки могут быть заполнены при помощи ДНК-полимеразы (рис. 15-31, стадия в), а разрывы могут быть сшиты полинуклеозид-лигазой.
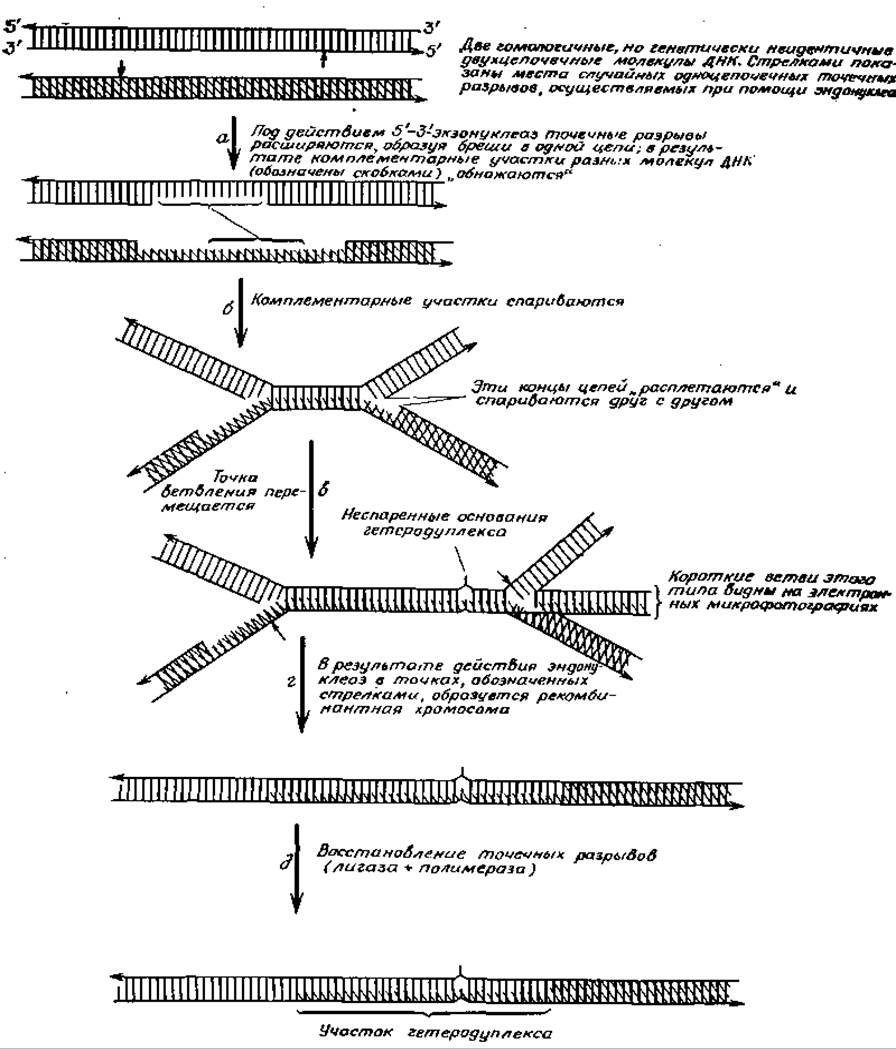
РИС. 15-31. Возможный механизм рекомбинации, включающий образование точечных разрывов в произвольных местах гомологичных двойных цепей ДНК, расширение этих разрывов до незаполненных промежутков и ассоциацию комплементарных участков. Механизм миграции боковой цепи позволяет далее заполнить образовавшиеся промежутки и снова «заправить» все пропуски, в результате чего образуется рекомбинантная молекула ДНК.
Против такого механизма рекомбинации свидетельствует то обстоятельство, что он требует образования достаточно длинных одноцепочечных участков в молекулах ДНК. Учитывая это, Холидей [222] предложил модель, не требующую образования подобных «хвостов». Процесс рекомбинации может начинаться в особых точках двухцепочечных молекул ДНК, распознаваемых ферментом рекомбинации (рис. 15-32, А). После раскручивания ДНК на небольшом участке произойдет обмен между двумя разорванными цепями, которые затем воссоединятся при помощи лигазы, как это показано на рис. 15-32, А. При вращении обоих спиралей вокруг своих осей точки перекреста будут перемещаться вверх или вниз по цепям, что приведет к образованию участков гетеро-дуплексной ДНК. Возможность остановки процесса на любом расстоянии от начальной точки позволяет объяснить универсальность генетических рекомбинаций. Процесс закончится разрывом нити и воссоединением двух цепей. В случае воссоединения тех цепей, которые были разорваны в процессе инициации (разрыв в точках аа' на рис. 15-32,А), гены, расположенные вне участка гетеродуплекса, не будут рекомбинироваться, но разрыв других цепей (точки bb') приведет к рекомбинации этих генов. Промежуточные состояния, предсказываемые моделью Холидея, удалось непосредственно наблюдать при помощи электронного микроскопа (рис. 15-32, Б) [222а].
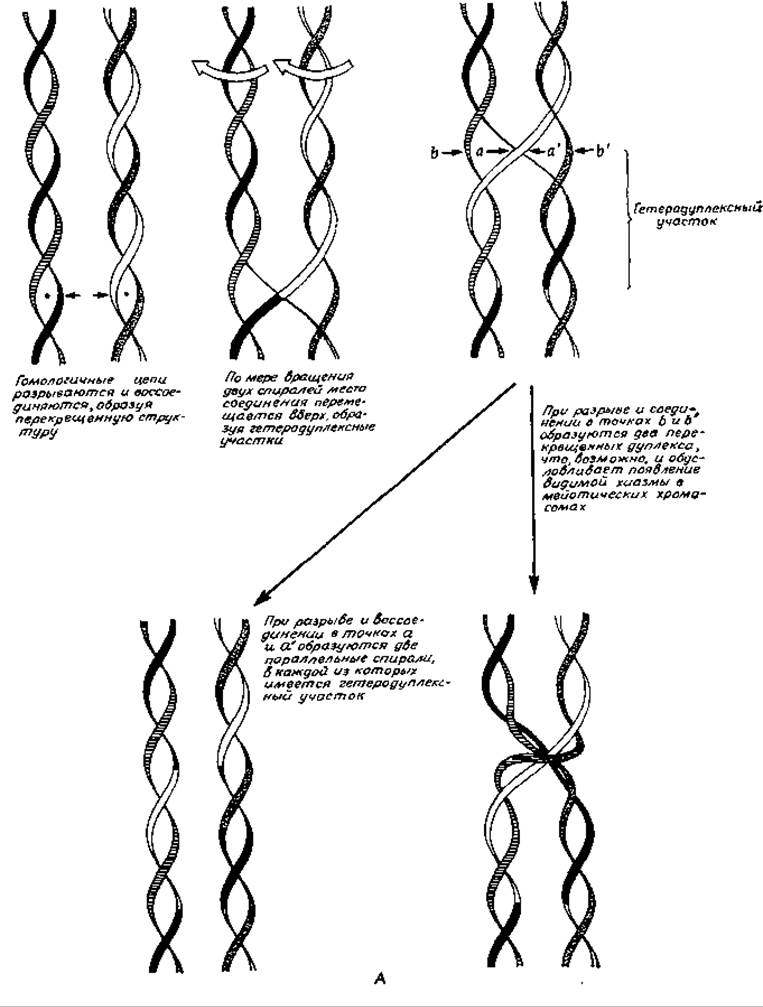
РИС. 15-32. А. Механизм рекомбинации по Холидею с одноцепочечными обменами.
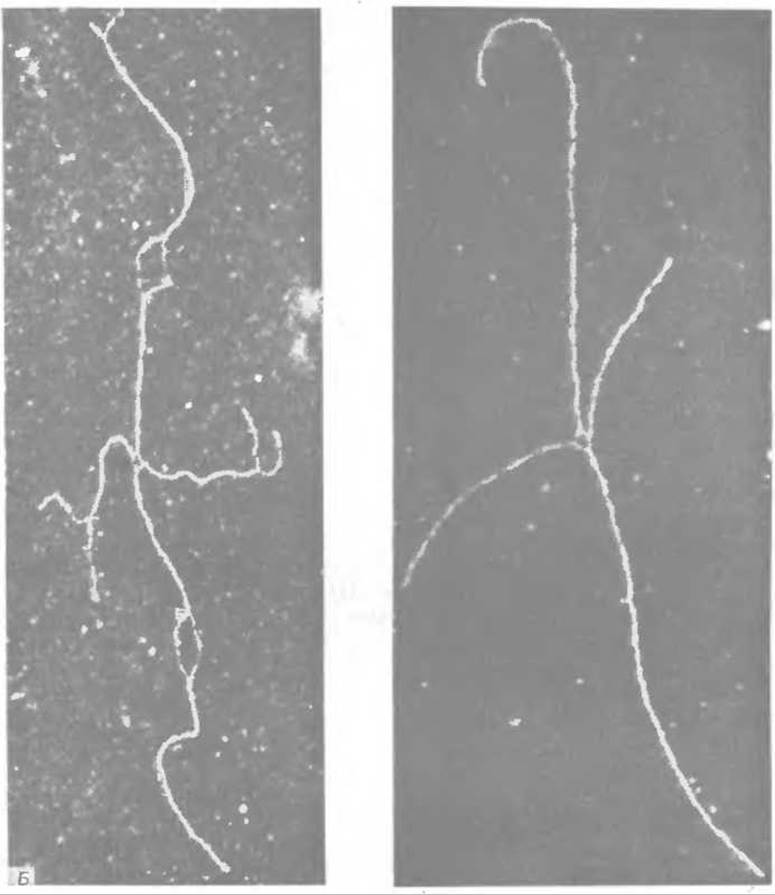
Б. «χ.-форма» ДНК плазмиды колицина ЕІ. Считают, что эти формы образуются из промежуточных молекул холидеевского типа, имеющих форму «восьмерки», длина которых в два раза больше длины генома колицина. Эти «восьмерки» разрезаются рестректирующим ферментом Eco RІ (разд. Е, 1) в специфическом месте, встречающемся в геноме только один раз, в результате чего образуются «у-формы». Считают, что пары коротких и длинных плеч представлены гомологичными дуплексами. Видно, как в точке перекреста единичные цепи разошлись в стороны, четко демонстрируя места соединения нитей. Эта структура может быть представлена как промежуточная, согласно модели Холидея (верхний правый угол на рис. А); она может образовываться, например, при вращении одного из вертикальных дуплексов вокруг другой. Препарат ДНК, изображенный справа, приготовлен при высоких концентрациях формамида, что позволяет увидеть денатурационные петли и «растрепанные» концы в участках, богатых АТ-парами (разд. Д, 3) [222а].
Подобные структуры с перекрещенными цепями могут быть образованы двумя интактными двухцепочечными молекулами ДНК любого нуклеотидного состава [223, 224]. Все, что необходимо для этого, — образование надрезов в каждой из полинуклеотидных цепей и воссоединение разноименных цепей с заполнением промежутка между двухцепочечными молекулами. Образование гетеро дуплекса может распространяться вдоль цепей за счет их взаимного вращения. С помощью этой модели можно объяснить также и тот факт, что перекрещенные нити оказываются разрезанными именно в тех точках, которые и нужны для завершения процесса рекомбинации ДНК.
Было предложено несколько модификаций модели, представленной на рис. 15-32 [223, 225]. Согласно модели Собелла [226, 227] и другим моделям [228], начальные надрезы происходят в крестообразных, структурах, образуемых в палиндромных участках (рис. 15-4).
При рекомбинации фагов S13 и —Х роль промежуточных соединений выполняют кольцевые димеры [229]. Такие, вдвое более длинные кольца, так же как и катенированные (сцепленные друг с другом) кольца, обычной длины, могут образовываться при рекомбинации, протекающей в соответствии с рассмотренными в предыдущих разделах механизмами, включающими разрывы цепей.
Наши знания о рекомбинации все еще далеко не полны, а некоторые наблюдения с трудом поддаются интерпретации. Так, например, гены rесВ и recC Е. coli детерминируют синтез белков, в результате соединения которых образуется необычный ДНК-гидролизующий фермент [230]. В числе прочих функций этот фермент, суммарный мол. вес которого составляет приблизительно 340 000, обладает способностью расщеплять одноцепочечную ДНК по «эндо»-типу. Хотя этот фермент и не может «надрезать» интактные двухцепочечные молекулы ДНК, он может участвовать в образовании некоторых предполагаемых эндо- и экзонуклеотидных разрывов в процессе рекомбинации. Интересно, что для действия этого фермента требуется АТР. В пробирке при разрыве каждой фосфодиэфирной связи ДНК около 20 молекул АТР гидролизуется до АДР и Рі. В отсутствие ДНК, являющегося субстратом этого фермента, расщепления АТР не происходит. Можно сомневаться в том, что этот фермент in vitro действует так же, как и in vivo, но его интересные свойства, а также необходимость для процесса рекомбинации делают его важным объектом дальнейших исследований. Согласно имеющимся данным, сходный фермент, выделенный из Bacillus subtilis, соединяет двухцепочечные молекулы ДНК друг с другом (поданным электронной микроскопии) [231]. Значение этого эффекта остается неясным.
Рекомбинация в клетках эукариот протекает преимущественно вовремя мейоза в синаптонемальном комплексе — структуре, расположенной между парой гомологичных хроматид. Было высказано предположение, что периодически наблюдаемые в этом комплексе «узелки»-(«nodules»), возможно, имеют какое-то отношение к процессу рекомбинации [232]. Во всяком случае, ясно, что кроссинговер и рекомбинация в клетках эукариот представляют собой сложные и высокоорганизованные и неразрывно связанные друг с другом процессы, о которых мы знаем сейчас крайне мало.