Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Включение NH3 в аминокислоты и белки
Глутаминсинтетаза
Образование глутамина из глутамата сопряжено с расщеплением АТР:
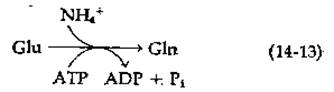
Глутаминсинтетаза, выделенная из Е. coli, содержит 12 идентичных субъединиц, каждая с мол. весом ~50 000. Они образуют два кольца по шесть субъединиц; расстояние между центрами соседних субъединиц внутри кольца составляет 4,5 нм. Субъединицы одного кольца лежат почти непосредственно над субъединицами следующего [21], и расстояние между центрами колец тоже составляет 4,5 нм. Фермент проявляет чрезвычайно сложные регуляторные свойства [22—24], суммированные на рис. 14-3. Глутаминсинтетаза существует в двух формах. Активная глутаминсинтетаза помимо трех субстратов — глутамата, NH+4 и АТР — требует еще присутствия Mg2+. В присутствии избыточных количеств предшественника, а-кетоглутарата, фермент остается в активной форме, поскольку превращение его в модифицированную форму в этих условиях ингибируется. Однако, если концентрация кетоглутарата падает до низких значений и накапливается глутамин, возникают условия, благоприятствующие модификации фермента. Модифицирующий фермент аденилилтрансфераза (АТаза) переносит аденилильную группу с АТР на гидроксил одного из тирозинов в субъединице глутаминсинтетазы, в результате чего образуется аденилильная форма фермента. Модифицированный фермент требует уже присутствия не Mg2+, а Мn2+. Он намного более чувствителен к ингибированию по типу обратной связи (ретроингибированию) целым рядом конечных продуктов метаболизма глутамина, как показано слева в нижней части рис. 14-3. Все восемь ретроингибиторов, по-видимому, связываются своими специфическими участками на поверхности фермента, оказывая кумулятивное ингибиторное действие.
Для релаксации от аденилилированной глутаминсинтетазы к немодифицированной форме не требуется особой гидролазы, как в случае фосфорилазы (рис. 11-10). Отщепление аденилильной группы катализируется модифицированной формой той же аденилилтрансферазы, под действием которой шло аденилилирование. Обнаружено, что АТаза существует в комплексе с регуляторным белком, обозначаемым как РII- Комплекс АТаза∙РII катализирует аденилилирование (перенос аденилильной группы с АТР на тирозиновый остаток глутаминсинтетазы). Регуляторная субъединица РІІ может быть уридилилирована под действием специальной уридилилтрансферазы (UТазы) в присутствии UTP. Комплекс АТаза-РSS—уридилил катализирует фосфоролитическое Дезаденилилирование глутаминсинтетазы (с переносом удаляемой аденилильной группы на Рi и образованием ADP). Наконец, удаление уридилильной группы с уридилил-РII катализируется четвертым, «UR»-ферментом. Цикл взаимопревращений РII, катализируемый UТазой и UR-ферментами, показан в нижней части рис. 14-3 справа. Реакции аллостерической модификации, отмеченные пунктирными линиями, показывают, что глутамин не только содействует аденилилированию глутаминсинтетазы, но также блокирует уридилилирование РII, препятствуя удалению под действием АТазы аденилильной группы из синтетазы. Более того, он аллостерически ингибирует и саму реакцию дезаденилилирования. С другой стороны, а-кетоглутарат на всех трех участках оказывает прямо противоположное действие. Несколько иной механизм был обнаружен у В, subtilis [25].
Помимо того, что она осуществляет синтез глутамина, глутаминсинтетаза имеет еще одну важную функцию. Активная глутаминсинтетаза (но не ее аденилилированная форма) связывается с промоторными участками ДНК (гл. 15, разд. Б, 1, б) и активирует транскрипцию целого ряда генов, в том числе гена нитрогеназы [25а, b]. Таким образом, когда содержание глутамина становится недостаточным, «включается» ряд генов, контролирующих метаболизм азота. Накопление же глутамина содействует модификации синтетазы и потере ею способности к активации генов.
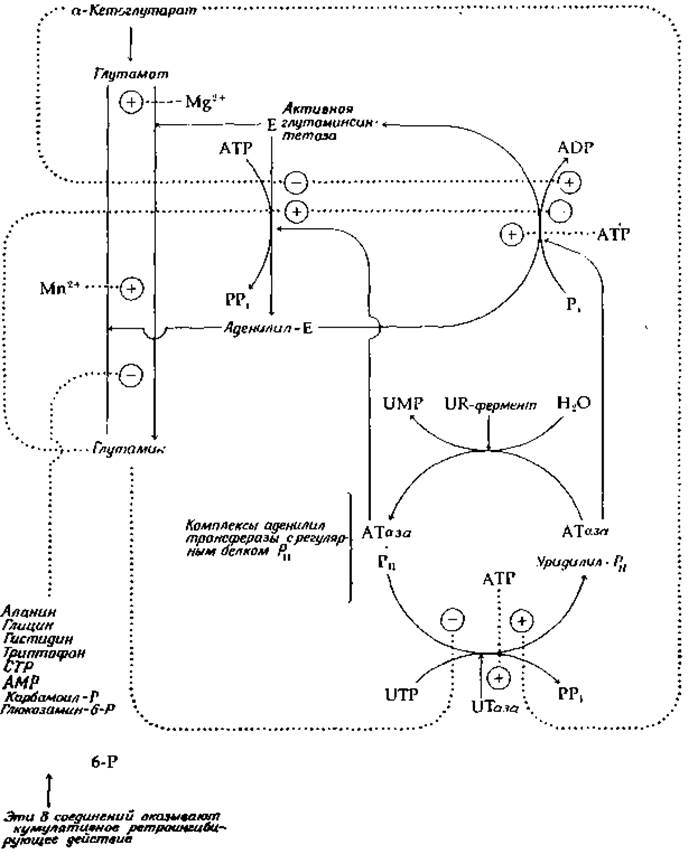
РИС. 14-3. Регуляция действия глутамиисинтетазы из Е. coli; знаком «плюс» в кружочке обозначена активация, знаком «минус» в кружочке — ингибирование.
Перенос азота с глутамина на другие субстраты рассматривается в обзоре Бьюкенена [26]. При изучении этих процессов были использованы различные аналоги глутамина, относящиеся к антибиотикам; например L-азасерин и 6-диазо-5-оксо-L-норлейцин (DON) — антибиотики, выделенные из стрептомицетов:
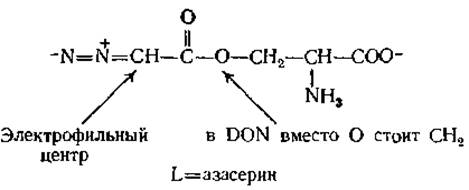
Эти соединения действуют как алкилирующие агенты; при этом освобождается N2, а нуклеофильная группа фермента присоединяется к указанному атому углерода.