Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Включение NH3 в аминокислоты и белки
Глутаматдегидрогеназа и глутаматсинтетаза
Согласно существующим представлениям, реакция, катализируемая глутаматдегидрогеназой (рис. 14-2, стадия а; см. также гл. 8, разд. 3,4), представляет собой основной путь обратимого включения аммиака в глутаминовую кислоту. Роль восстановителя в этой реакции может играть либо NADH, либо NADPH. В эукариотических клетках глутаматдегидрогеназа находится преимущественно в митохондриях. Далее под действием трансаминаз внутри и вне митохондрий азот глутаминовой кислоты перераспределяется, включаясь в другие аминокислоты. Особенно активна аспартатаминотрансфераза (гл. 8, разд. Д, 3 и Д, 7), поддерживающая равновесие между аспартатом и оксалоацетатом, с одной стороны, и парой а-кетоглутарат/глутамат— с другой.
У Е. coli и многих других бактерий восстановительное аминирование а-кетоглутарата осуществляется под действием глутаматсинтетазы (рис. 14-2, стадия б). В этой реакции азот поставляется амидной группой глутамина. Есть все основания считать, что в активном центре фермента из этой группы освобождается аммиак. Следовательно, образование шиффова основания и восстановление под действием NADPH может идти точно так же, как и в реакции а (гл. 8, разд. 3,4). Разница состоит в том, что одна из двух молекул глутамата, образовавшихся в реакции б, должна быть переведена под действием глутаминсинтетазы (разд. Б, 2) снова в глутамин с использованием одной молекулы АТР.
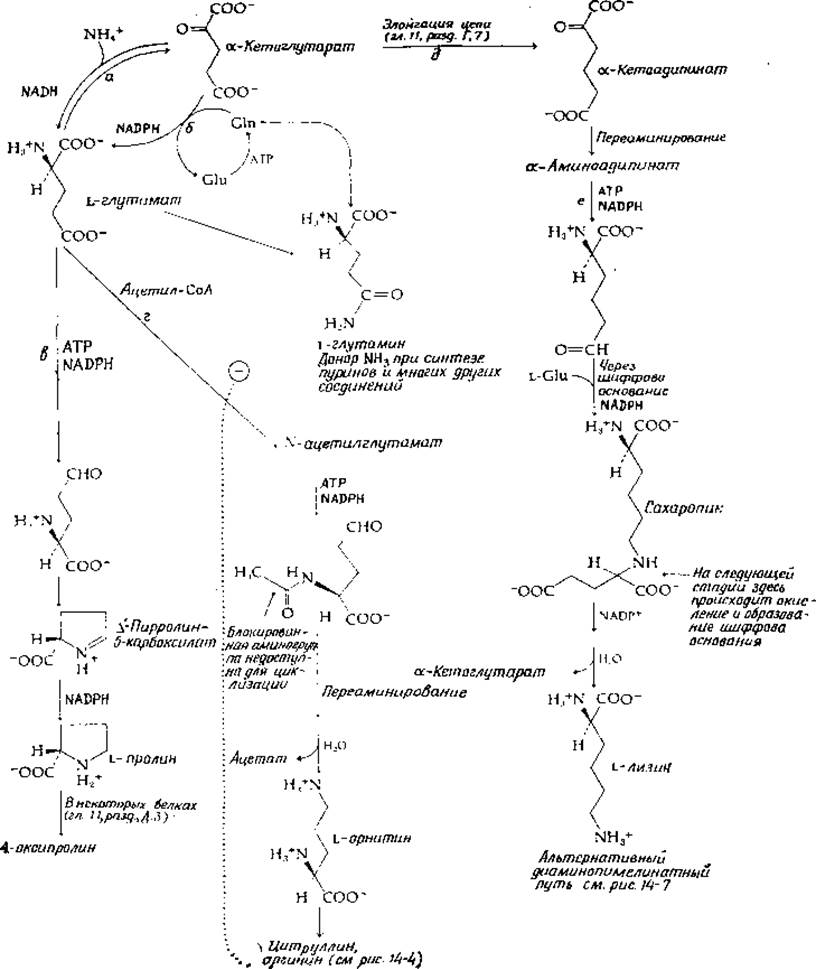
РИС. 14-2. Биосинтез глутаминовой кислоты, глутамина, пролина и лизина из а-кетоглутарата.
Вследствие такого сопряжения реакции с расщеплением АТР равновесие в реакции б сильно сдвинуто в сторону синтеза глутамата. Для глутаматсинтетазы характерно очень низкое значение Км по отношению к глутамину (а следовательно, и к его амидному азоту).
Глутаматсинтетаза Е. coli представляет собой крупный белок с мол. весом 800 000, содержащий флавин, железо и S2- в соотношении 1:4:4 [18]. В качестве восстановителя фермент использует NADH, однако некоторые эксперименты свидетельствуют, что прочно связанный с ферментом флавин после своего восстановления служит непосредственным донором электронов, необходимых для восстановления шиффова основания, образованного а-кетоглутаратом c аммиаком [18]. Не вполне ясно, для чего нужны флавиновые и железо-сульфидные простетические группы. Железо-сульфидная группа, возможно, обеспечивает сопряжение не только с NADPH, но и с восстановленным ферредоксином.
Недавно было обнаружено, что глутаматсинтетаза, по-видимому, обеспечивает основной путь включения азота в аминокислоты в дрожжах [19] и высших зеленых растениях. В последнем случае восстанавливающим агентом может служить восстановленный ферредоксин [20].