Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Метаболизм пиримидинов и пуринов
Биосинтез пиримидинов
Все клетки должны быть способны вырабатывать пиримидиновые и пуриновые основания, используемые в синтезе нуклеиновых кислот и коферментов. Во многих организмах путь, ведущий к образованию пуринов, используется особенно интенсивно, судя по тому, что главным продуктом выделения из организма избыточного азота служит мочевая кислота или родственные соединения. Такова особенность азотистого обмена у птиц и пресмыкающихся, которые экскретируют мочевую кислоту, а не мочевину, и у пауков, экскретирующих гуанин.
Перенос карбамоильной группы с карбамоилфосфата на аспартат (рис. 14-29, стадия а) приводит к образованию продукта, способного к немедленной циклизации путем элиминирования воды; в результате образуется дигидрооротат. Карбамоилтрансфераза является в высокой степени регулируемым ферментом, и в настоящее время она служит объектом интенсивных исследований (гл. 4, разд. Г, 8; гл. 6, разд. Б, 7). Дигидрооротат окисляется особым флавопротеидом за счет NAD+, являющегося внешним окислителем. На следующей стадии (рис. 14-29, стадия г) образовавшаяся оротовая кислота соединяется с фосфорибозильным остатком молекулы PRPP [уравнение (14-42)], в результате чего образуется первый нуклеотид, оротидин-5'-фосфат.
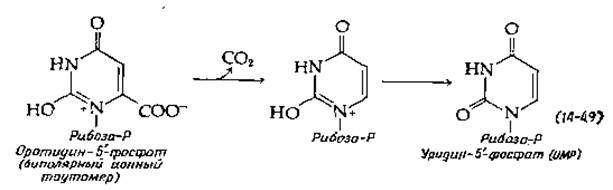
Оротидин-5'-фосфат подвергается декарбоксилированию необычного типа (рис. 14-29, стадия д), для которого, по-видимому, не требуется кофермента. Высказано предположение, что фермент стабилизирует биполярный ионный таутомер субстрата. Декарбоксилированию уpaвнение (14-49)] мог бы способствовать расположенный по соседству положительный заряд [149]. В итоге из аспартата сравнительно прямым и простым путем образуется уридин-5'-фосфат (UMP). Двукратное фосфорилирование с помощью АТР дает UDP и UTP.
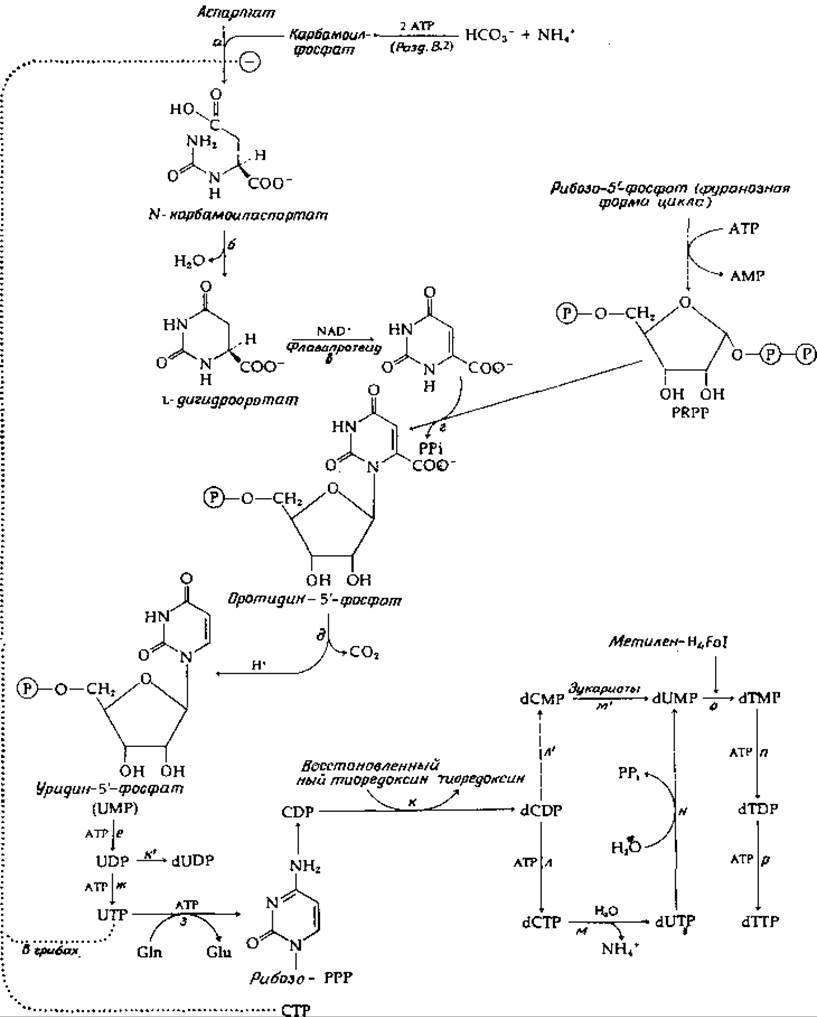
РИС. 14-29. Биосинтез пиримидиновых нуклеотидов.
Цитозиновые нуклеотиды образуются из UTP; начальной стадией служит аминирование с образованием СТР (рис. 14-29, стадия з). Эта реакция во многих отношениях сходна с превращением цитруллина в аргинин — реакцией, требующей участия АТР и включающей перенос азота из молекулы аспартата (разд. В, 2). Однако при образовании СТР донором азота служит амидная группа глутамина (может быть использован NH4+). СТР включается в состав РНК и в такие промежуточные метаболиты, как CDP-холин; может также происходить дефосфорилирование СТР с образованием CDP. Именно CDP служит главным предшественником дезоксирибонуклеотидов dCDP и тимидин-дифосфата.
а. Образование дезоксирибонуклеотидов
Рибонуклеотиддифосфаты превращаются в соответствующие 2-дезоксисоединения (стадия к, рис. 14-29) в итоге цепи реакций, протекающих с участием NADPH, флавопротеида тиоредоксина (гл. 8, разд. И, 2 и М, 4) и рибонуклеотидредуктазы, как указано в уравнении (14-50).
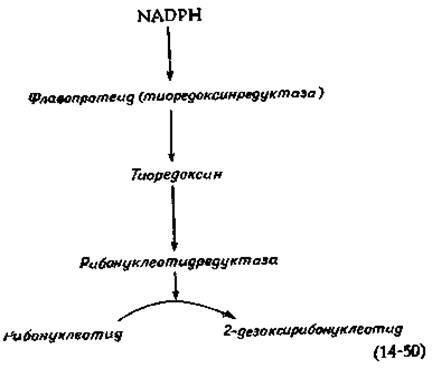
Рибонуклеотидредуктаза Е. coli состоит из двух неидентичных субъединиц, одна из которых содержит негемовое железо [150]. У нескольких видов бактерий и у евглены требуется присутствие витамина В12, а процесс восстановления происходит на уровне нуклеозидтрифосфатов [151]. Система, используемая клетками Lactobacillus, описана в гл. 8, разд. М, 4. Рибонуклеотидредуктаза млекопитающих, возможно сходная с ферментом Е. coli, рассматривается как подходящая мишень для противоопухолевых препаратов. Активность фермента регулируется сложным набором механизмов обратной связи, что, вероятно, обеспечивает синтез предшественников ДНК лишь в тех количествах, какие необходимы для синтеза ДНК [152]. Поскольку избыток одного дезоксирибонуклеотида может ингибировать восстановление всех рибонуклеозиддифосфатов, оказывается возможным ингибировать синтез ДНК либо дезоксиаденозином, либо высокими концентрациями тимидина, хотя оба эти соединения служат предшественниками ДНК.
Фосфорилирование dCDP с образованием dCTP (стадия л, рис. 14-29) завершает биосинтез первого из пиримидиновых предшественников ДНК. Уридиннуклеотиды получаются двумя путями. Восстановление UDP дает dUDP (стадия к, рис. 14-29). Чаще происходит гидролитическое дезаминирование дезоксицитидиновых нуклеотидов (реакции м и м', рис. 14-29). Метилирование, приводящее к образованию тиминнуклеотидов, осуществляется через образование dUMP. Последний может быть получен гидролитическим отщеплением фосфата от dUDP или, у эукариот, путем превращений dCDP->dCMP->dUMP (стадии л' и м', рис. 14-29). С другой стороны, Е. coli использует более обходный путь dCDP->dCTP->dUTP->dUMP (стадии л, м и н, рис. 14-29). Одним из промежуточных соединений является dUTP. Интересно, что ДНК-полимеразы способны включать это соединение в полинуклеотиды. Единственной причиной, по которой этого не происходит в клетках (что привело бы к образованию урацилсодержащей ДНК), является то, что dUTP быстро превращается пирофосфатазой в dUMP (стадия м, рис. 14-29).
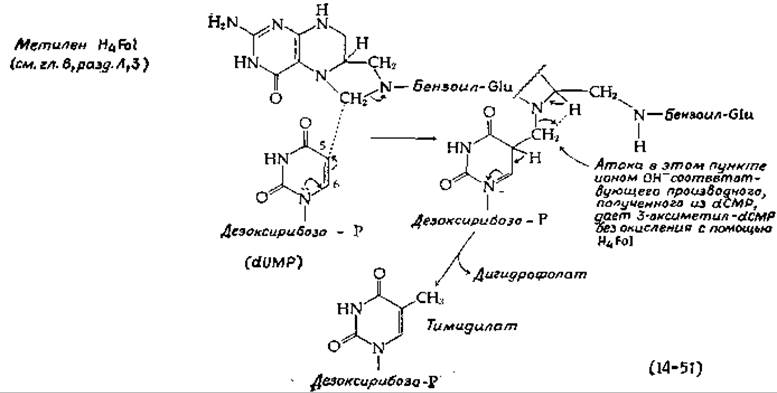
Образование тимидиловой кислоты (dTMP) из dUMP (стадия о, рис. 14-29) катализируется тимидилат-синтетазой. Реакция, описываемая уравнением (14-51), представляет собой перенос одноуглеродного остатка, отщепляемого от метилентетрагидрофолиевой кислоты [153]. Несколько иной механизм, предложенный на основании модельных экспериментов, включает реакцию присоединения к атому С-6, которую облегчает присутствие соседней нуклеофильной группы [154].
Интересные изменения метаболизма нуклеотидов наблюдаются в клетках Е. coli, зараженных Т-четными фагами. При этом происходит транскрипция фаговых генов и синтез клеткой-хозяином соответствующих белков [155]. Среди этих продуктов вирусных генов имеется ряд ферментов, оказывающих влияние на метаболизм нуклеотидов. Три из них показаны на рис. 14-30 прерывистыми стрелками. Один фермент катализирует гидролитическое превращение dCTP в dCMP, а другой осуществляет синтез 5-оксиметил-dСМР. Такого типа вирусоспецифические ферменты могут оказаться подходящими мишенями для действия противовирусных препаратов.
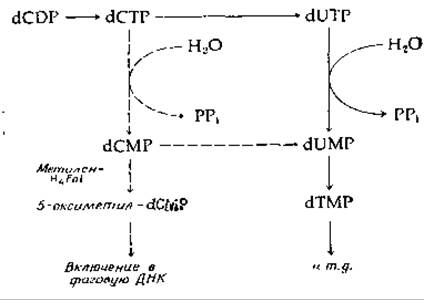
РИС. 14-30. Некоторые изменения метаболизма нуклеотидов в клетках Е. coli, индуцированные заражением Т-четными бактериофагами; (—>) нормальные метаболические пути, (— — — —>) метаболические пути, индуцированные фагами.
Дополнение 14-Г
Тимидилат-синтетаза, фермент-мишень для химиотерапии ракаa
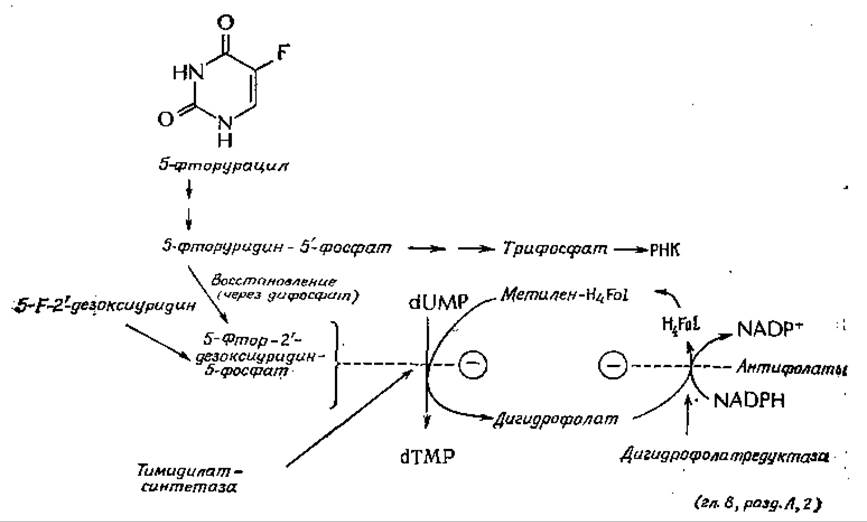
Если клетку, будь то бактериальная клетка или клетка животного, лишить тимина, то она уже не сможет синтезировать ДНК. Однако синтез белков и РНК может при этом продолжаться. Это можно показать экспериментально, используя мутантов, нуждающихся в тимине. Тем не менее эти клетки рано или поздно теряют жизнеспособность и погибают. Причина такой бестиминовой смерти неясна. Возможно, тимин необходим для репарации повреждений ДНК, и при его отсутствии происходит транскрипция поврежденной ДНК, что в конечном итоге приводит к синтезу дефектного белка. Но какова бы ни была причина, это явление положено в основу некоторых наиболее эффективных подходов к химиотерапии рака. Раковые клетки со свойственным им быстрым метаболизмом особенно чувствительны к отсутствию тимина. Поэтому тимидилат-синтетаза оказывается одной из наиболее удачных мишеней для воздействия ингибиторами. Одним из мощных ингибиторов этого фермента является монофосфат 5-фтор-2'-дезоксиуридина. Его ингибирующее действие было обнаружено, когда выяснилось, что 5-фторурацил можно использовать для химиотерапии рака.
Действие фторурацила на клетки может быть различным. Он может включаться и в состав РНКб, но наиболее важное значение для химиотерапии рака имеет, по-видимому, ингибирование тимидилат-синтетазы продуктом его восстановления. 5-фтор-2'-дезоксиуридин гораздо менее токсичен, чем 5-фторурацил, и оказался более эффективным лекарственным препаратом. Следует заметить, что тимидилат-синтетаза требует присутствия метилентетрагидрофолата в качестве восстановителя и что важным звеном всего процесса является восстановление дигидрофолата. Как уже было указано (гл. 8, разд. Л, 2), к числу наиболее эффективных противоопухолевых препаратов относятся такие аналоги фолиевой кислоты, как метотрексат (N10-метил-4-амнно-4-дезоксифолиевая кислота). Их действие связано с ингибированием дигидрофолатредуктазы, что (помимо всего прочего) лишает тимидилат-синтетазу необходимого для нее субстрата.
а Таково название разд. V статьи Фридкина Adv. Enzymol., 38, 235—292 (1973), посвященной тимидилат-синтетазе.
б Horowitz J., Оu С.-N., Ishag М., Ofehand J., Bierbaum J., JMB, 88, 301—312 (1974).
б. Повторное использование оснований
Точно так же, как оротовая кислота превращается в рибонуклеотид на стадии г, рис. 14-29, с PRPP могут реагировать и другие свободные пиримидиновые и пуриновые основания, давая в качестве продуктов монорибонуклеотиды и РРі. Эти реакции составляют путь регенерации, при помощи которого пуриновые и пиримидиновые основания, освободившиеся при распаде нуклеиновых кислот, могут быть использованы повторно. Однако следует отметить, что тимин обычно повторно не используется. Тем не менее для биохимиков одним из важных экспериментальных приемов является введение радиоактивного тимина или тимидина в состав ДНК в живом организме. Тимидин быстро фосфорилируется в dTTP действующими последовательно киназами. Другой важной реакцией повторного использования пиримидинов является превращение цитозина в урацил путем гидролитического дезаминирования аналогично тому, как это происходит на стадии м, рис. 14-29.