Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Транскрипция молекул РНК
РНК-полимеразы н их регуляция
РНК-полимеразы — это ферменты, осуществляющие транскрипцию генетической информации с цепи ДНК. Поскольку ДНК в клетке состоит из двух цепей, невольно возникает вопрос: каким образом на двухцепочечной матрице может образовываться одноцепочечная РНК? Частичный ответ на этот вопрос следует из того факта, что очищенные РНК-полимеразы способны также синтезировать РНК из четырех рибонуклеозидтрифосфатов, используя в качестве матрицы одноцепочечную ДНК. Этот факт позволяет предположить, что механизм транскрипции, подобно механизму репликации ДНК, включает в себя спаривание оснований. С этим выводом хорошо согласуется способность РНК-полимеразы превращать одноцепочечную ДНК из бактериофага —X174 (дополнение 4-В) в двухцепочечную гибридную молекулу РНК—ДНК. Однако в тех случаях, когда матрицей служит двухцепочечная ДНК, образуются свободные одноцепочечные молекулы РНК. Из сказанного следует, что в месте действия РНК-полимеразы двухцепочечная ДНК кратковременно разделяется на отдельные цепи, одну из которых и копирует РНК-полимераза.
Удивительно, что внутри клеток в данном генетическом участке обычно транскрибируется только одна из двух цепей двойной спирали ДНК. Это было четко показано на примере двухцепочечной репликативной формы ДНК фага —Х174. Эта ДНК представляет собой кольцевую молекулу, одна из цепей которой активно транскрибируется в клетках Е. coli, инфицированных этим бактериофагом. Оказалось, что транскрибированная таким образом и выделенная из бактерий мРНК не гибридизуется с одноцепочечной ДНК фага —Х174, выделенной из зрелых вирусных частиц. Эту цепь ДНК обычно называют «плюс»-цепью. Это значит, что транскрибированная РНК также представляет собой «плюс»-цепь и, следовательно, транскрибируется с «минус»-цепи репликативной формы ДНК. Подтверждением этому выводу служит тот факт, что выделенная РНК легко гибридизуется с денатурированной двухцепочечной репликативной формой ДНК, в которой содержатся как «плюс»-, так и «минус»-цепи.
РНК-полимеразы представляют собой крупные белковые молекулы; некоторые из этих белков состоят из субъединиц [40, 51—53]. Любобытно следующее: митохондриальная РHК-полимераза эукариотических клеток может быть мономерным белком с мол весом 64 000 и иметь более простое строение, чем фермент бактерий. Вирусы бактерий иногда индуцируют свои собственные РНК-полимеразы, также имеющие мономерное строение. Так, фаг Т7 индуцирует РНК-полимеразу с мол. весом 100 000, представляющую собой одну длинную полипептидную цепь. Наиболее хорошо изученная РНК-полимераза — это РНК-полимераза Е. coli, представляющая собой олигомер с мол. весом ~ 500 000, состоящий из субъединиц четырех типов а, ß, ß', σ и содержащий связанные ионы Zn2+. Состав олигомера описывается следующей формулой: a2, ß, ß', σ. Молекулярные веса а-, σ-, ß- и ß'-субъединиц равны соответственно 39000, 86000, 155 000 и 165000. Субъединица σ играет особую роль в инициировании транскрипции. Она необходима для правильного выбора премоторных участков и начала синтеза, но после того как синтез РНК уже начался, для элонгации цепи РНК она больше не нужна. В эукариотических клетках обнаружено по меньшей мере три различных класса РНК-полимераз. Полимераза I (или А) обнаружена в ядрышке; она транскрибирует, вероятно, гены пре-рРНК. (разд. Б, 3). Полимеразы II (или В) и III (или С) были обнаружены в нуклеоплазме. Согласно имеющимся данным, ферменты типа II транскрибируют большую часть генов, тогда как ферменты типа III транскрибируют гены транспортных РНК. Подобно полимеразе бактерий, РНК-полимеразы эукариотических клеток имеют сложное олигомерное строение [53, 53а].
а. Инициация транскрипции
Согласно современным представлениям о процессе инициации, РНК-полимераза многократно связывается с ДНК в случайных местах и отщепляется от нее до тех пор, пока она не свяжется с промоторным участком. При этом считается, что фермент «узнает» промотор, специфически взаимодействуя с основаниями (большой бороздки спирали ДНК (рис. 2-23). Согласно расчетам, для возникновения уникальной последовательности, «узнающей» РНК-полимеразу, необходимо вполне определенное сочетание приблизительно 12 пар оснований, случайное появление которого в хромосоме Е. coli маловероятно [40].
Исходный специфический комплекс полимераза — промотор называют закрытым комплексом, так как считается, что основания в цепи ДНК остаются все еще спаренными. Постулируется, что закрытый комплекс находится в равновесии с открытым комплексом, готовым к началу синтеза мРНК; переход закрытого комплекса сопровождается значительными конформационными изменениями [39, 40]. В открытом комплексе водородные связи между комплементарными основаниями ДНК-матрицы уже разрушены и основания матрицы доступны длят спаривания с поступающими рибонуклеозидтрифосфатами.
Еще раз вернувшись к рис. 15-4, А, обратим внимание на последовательность GAAATGTGAAAT (в нижней цепи). В этой последовательности нет участков с локальной симметрией, однако есть дважды повторяющийся пентамер GAAAT. Находясь в центре гипотетичного участка связывания с полимеразой, он может играть роль распознающей области промотора. Асимметричность строения может быть нужна для связывания белка, функция которого состоит в продвижении в определенном направлении. Кроме того, этот участок обогащен АТ-парами, и, следовательно, спираль раскрывается в этом месте легче, чем в участках, богатых GC-парами (гл. 2, разд. Г, 6). Таким образом, местом присоединения РНК-полимеразы в процессе образования открытого комплекса может служить именно этот участок [39].
Диксон и др. высказали предположение, что более легкое присоединение РНК-полимеразы к прилегающему промоторному участку и присутствии комплекса САР—сАМР обусловлено, вероятно, тем, что этот комплекс способствует дестабилизации GC-богатых участков между местами связывания САР и полимеразы [39]. После того как открытый комплекс уже образуется, полимераза должна (как это следует из рис. 15-4) еще передвинуться на небольшое расстояние вдоль цепи ДНК к стартовой точке синтеза мРНК.
Инициация синтеза цепи РНК начинается реакцией АТР или GTP' со второй молекулой рибонуклеозидтрифосфата [уравнение (15-5)], приводящей к образованию динуклеотида, с 5'-концом которого все еще связан трифосфат.
ATP (GTP)ХТР → PPі+pppPupX. (15-5)
В дальнейшем за счет реакций этого типа нуклеотидные субъединицы присоединяются к 3'-концам. Скорость транскрипции составляет при этом приблизительно 50 нуклеотидов в 1 с при 25 °С, что приблизительно в 30 раз ниже скорости репликации ДНК.
б. Действие антибиотиков
Антибиотик рифамиции, по-видимому, препятствует инициации конкурируя с исходным пуриновым нуклеозид-5'-трифосфатом за место связывания (дополнение 15-А). В бактериальной клетке та же РНК-полимераза, которая синтезирует мРНК, катализирует также синтез рРНК и тРНК. Таким образом, рифамиции ингибирует в бактериях синтез всех форм РНК. При воздействии на популяцию бактерий этим антибиотиком некоторые особи выживают. У этих устойчивых к рифамицину мутантов чувствительность к антибиотику утрачена. Среди резистентных мутантов есть бактерии, продуцирующие РНК-полимеразу с измененным строением ß-субъединицы. Поскольку такие мутантные полимеразы не связывают рифамицина, был сделан вывод, что рифамицин связывается с ß-субъединицей и что за синтез этой субъединицы отвечает ген устойчивости к рифамицину ген rpoВ или rif (положениe на карте — 89 мин; рис. 15-1), который и является геном, кодирующим ß-субъединицы РНК-полимеразы.
Ряд других антибиотиков также препятствует транскрипции. Стрептолидигин ингибирует как инициацию, так и элонгацию цепей РНК. Актиномиции D ингибирует как ДНК-полимеразы, так и РНК-полимеразы, причем последние даже при концентрации 10-6 М (дополнение 15-Б). Эукариотические РНК-полимеразы не ингибируются рифамицином, однако две из них, а именно РНК-полимеразы II и III, полностью ингибируются а-аманитином, представляющим собой сильный яд, содержащийся в некоторых грибах (дополнение 15-В).
Дополнение 15-А
Антибиотики рифамицин и рифампицина
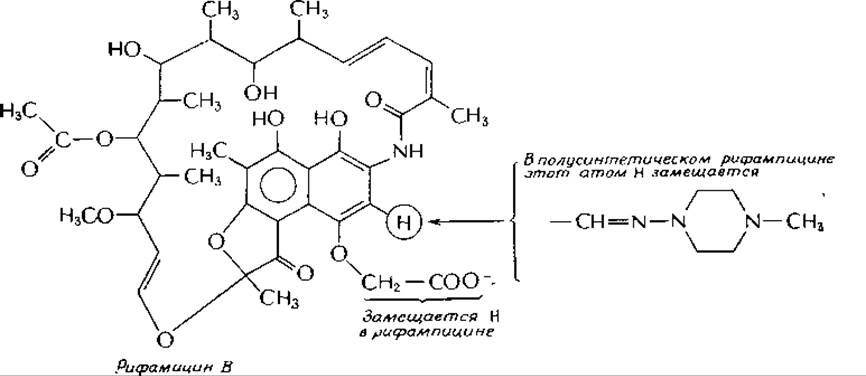
Рифамицин, антибиотик, продуцируемый Streptomyces mediterranei, широко используется в медицине, поскольку он действует как на кислотоустойчивые, так и на грамположительные бактерии. Полуеинтетический рифампицин оказался особенно эффективным при лечении туберкулеза. Обратите внимание на правое кольцо в структурной формуле. Эфирная связь разрывается, и образующийся гидрохинон окисляется до хинона в бактериальной клетке.
Рифампицин — чрезвычайно эффективный ингибитор бактериальной РНК-полимеразы; при концентрации антибиотика 2∙10-8 М степень ингибирования достигает 50%. Рифампицин не препятствует связыванию полимеразы с ДНК, но ингибирует инициацию транскрипции. У мутантов Е. coli, резистентных к рифампицину (rif-ген), образуется РНК-полимераза с измененной ß-субъединицей (иногда это проявляется и в изменении электрофоретической подвижности). Родственный антибиотик стрептолидигии также связывается с ß-субъединицей РНК-полимеразы и блокирует элонгацию. На хромосомной карте мутации, обусловливающие резистентность к этому антибиотику, располагаются очень близко к rif-мутациям.
а Goldberg J. Н., Friedman Р. A., Annu. Rev. Biochem., 40, 775—810 (1971).
Дополнение 15-Б
Актиномицин D, токсичный антибиотик
Актиномицины — антибиотики, продуцируемые Streptomyces, — не только убивают бактерии, но обладают также сильным противоопухолевым действиема. Однако из-за исключительно высокой токсичности они не могут быть использованы для лечения рака. Актиномицин находит широкое применение в биохимических исследованиях, что объясняется его способностью подавлять с высокой степенью специфичности действие РНК-полимераз.
Молекула актиномицина D (актиномицина С1) содержит плоский феноксазоновый хромофор, несущий две карбоксильные группы. Обе эти группы соединены с одинаковыми циклическими пептидами, состоящими из остатков L-треонина, D-валина, L-пролина, саркозина (N-метилглицина) и L-метилвалина.
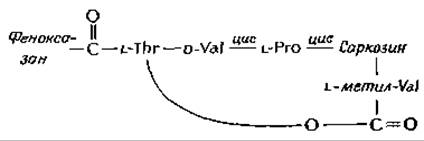
Метилвалиновый остаток пептида соединен эфирной связью с гидроксильной группой; боковой цепи треонина.
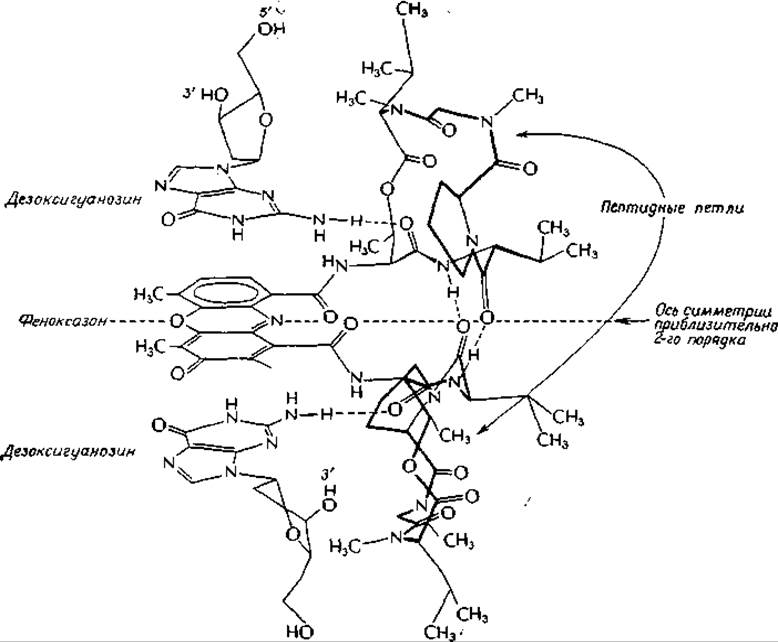
Кроме того, имеются еще две цис-пептидные связи. Если не учитывать очевидных структурных различий с двух сторон феноксазинового кольца, то можно считать, что актиномицин обладает приблизительной симметрией второго порядка. В результате биохимических исследований было установлено, что этот антибиотик прочно связывается с двухцепочечной ДНК в участках, содержащих гуанин.
Комплекс (2:1) дезоксигуанозин — актиномицин был получен в кристаллическом виде, и его строение исследовано методом рентгеноструктурного анализаб-г. Оказалось, что феноксазиновое кольцо расположено в центре комплекса, одна пептидная петля находится над ним, а другая — под ним (на рисунке справа). Строение пептидной цепи наиболее удобно можно проследить для верхней петли. В дидезоксигуанозиновом комплексе сохраняется та же симметрия второго порядка, что и в самом актиномицине. Фенаксозиновое кольцо удерживается между плоскими гуанозиновыми кольцами за счет сил Ван-дер-Ваальса. Обратите внимание, что две аминогруппы гуаниновых колец образуют прочные водородные связи с карбонильными группами остатков треонина. Наряду с ними имеются также более слабые, нелинейные водородные связи между атомами N-3 гуанинов и NH-гpyппами тех же остатков треонина. Симметричная пара водородных связей соединяет две карбонильные и NH-группы D-валиновых остатков в пептидных петлях.
Исследования с использованием пространственных моделей показали, что аналогичный комплекс может быть образован актиномицином и с двухцепочечной ДНК. Обратите внимание на то, что в то время, как показанные на рисунке две аминогруппы гуаниновых колец образуют водородные связи с актиномицином, другие водородные атомы тех же аминогрупп, так же как и атомы водорода при N-1 и карбонильные группы гуанинового кольца, доступны для водородных связей, образующих ГЦ-пары. Таким образом, показанная на рисунке структура может быть легко превращена в часть двухцепочечной молекулы ДНК, в которой феноксазиновое кольцо актиномицина интеркалировано между двумя GC-парами (рис. 2-21). Для того чтобы это произошло, ДНК должна развернуться на 180° в месте включения дополнительного кольца.
Изучение структуры кристаллического актиномицин-дезоксигуанозинового комплекса имеет прежде всего то значение, что позволяет графически доказать реальную возможность интеркалирования плоских колец в молекулы нуклеиновых кислот. Этот метод показывает также, каким образом специальный реагент, обладающий приблизительной симметрией второго порядка, может избирательно связываться с участками молекулы ДНК, также обладающими осью симметрии второго порядка.
Структурные исследования имеют важное значение и для медицины. Зная механизм токсического действия актиномицина, мы, возможно, сумеем осуществить такую химическую модификацию молекулы антибиотика, при которой его токсичность для нормальных клеток снизится, а для клеток опухоли останется прежнейб. Другой путь, предложенный Собеллом, — это получение актиномициноподобного антибиотика, способного специфически взаимодействовать с двойной спиралью вирусной РНК.
а Perlman D., in: Medicinal Chemistry (A. Burger, ed.), 3rd ed., Part I, pp. 309—316, Wiley (Interscience), New York, 1970.
б The Structure, as sketched here, is slightly distorted from the computergenerated drawings of Sobell to show the bonding arrangement more clearly. H. M. Sobell, Prog. Nucleic Acid Res. Mol. Biol., 13, 153—190 (1973).
в Sobell H. M., Jain S. C., Sakore T. D., Pontlcello G., Cold Spring Harbor Symp. Quant. Biol., 36, 263—270 (1971).
г Sobell H. M., Sei. Am., 231, 82—91 (Aug. 1974).
Дополнение 15-B
Сильный яд грибов: а-аманитин
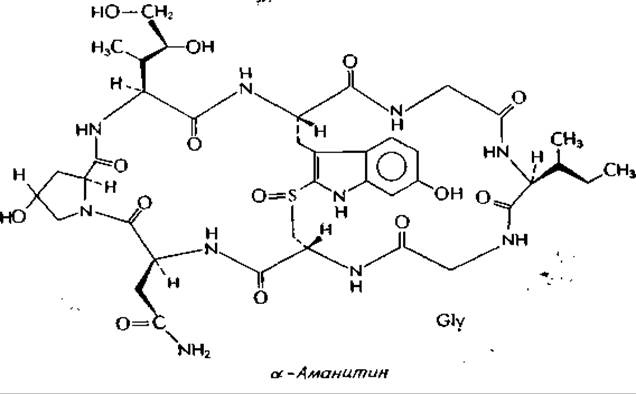
Некоторые смертоносные виды грибов рода Amanita продуцируют бесцветные, токсичные октапептиды, аманитиныа. Молекула высокотоксичного а-аманитина содержит два остатка глицина, один остаток L-изолейцина, один остаток необычного 1-диоксиизолейцина, один остаток L-аспарагина и один остаток L-оксипролина. Расположенный в центре модифицированный остаток триптофана путем окисления связан с S—Н-группой остатка цистеина. Величина LD50 для мыши составляет 0,3 мг∙кг-1 (для гибели человека может оказаться достаточным 50 г свежих грибов Amanita phalloides). Аманитины действуют медленно: мышь невозможно умертвить раньше, чем через 15 ч, независимо от дозы. При замене диоксиизолейцинового остатка а-аманитина на негидроксилированный лейцин образуется амануллин — абсолютно нетоксичное соединение.
а-Аманитин полностью блокирует транскрипцию под действием эукариотических РНК-полимераз II и III. Полимераза II представляет собой, по-видимому, основную ядерную полимеразу, и ее ингибирование практически полностью блокирует синтез белка в клетке. Обратите внимание, что, подобно актиномицину (дополнение 15-Б), молекула аманитина
в целом имеет полусимметричную структуру с выступающей в центре ароматической группой. Не исключено, что аманитины, подобно актиномицину, взаимодействуют с симметричным участком полимеразы или комплекса полимераза—ДНК.
В тех же грибах содержится ряд быстродействующих токсичных гептапептидов, фаллоидинов, строение которых сходно со строением аманитинов. Однако в отличие от аманитинов они содержат восстановленный атом серы (—S—), играющий роль мостика. Механизм действия фаллоидинов не известен. Эти грибы содержат, кроме того, антаманид — противоядие фаллоидинам. Этот циклический декапептид подобно токсинам, состоит только из L-аминокислот. Антаманид конкурирует с фаллоидинами за связывающие места. К сожалению, при отравлении грибами он не дает эффекта.
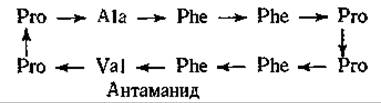
Антаманид — ионофор, специфически связывающий натрий (рис. 5-5).
а Wieland Т., Wieland О., Microb. Toxins, 8, 249—280 (1972).
в. Выбор нуклеотида при спаривании оснований
Каким образом клеткам удается достичь столь высокой степени точности в выборе нужного основания в процессах репликации и транскрипции, а также при спаривании кодона с антикодоном в процессе синтеза белка? В ранних работах исследователи часто высказывали мнение, что специфичность спаривания оснований определяется исключительно образованием двух (или соответственно трех) водородных связей и стабилизацией за счет взаимодействия соседних участков спирали. Оказалось, однако, что свободная энергия образования пар оснований мала (гл. 2, разд. Г, 6), а дополнительная свободная энергия, обусловленная связыванием основания с концом уже существующей цепи, не в состоянии обеспечить специфичность спаривания. Исходя из современных энзимологических данных, можно предположить, что важную роль в обеспечении правильности спаривания играет сам фермент. РНК- и ДНК-полимеразы — достаточно крупные молекулы. Следовательно, связывающее место фермента может полностью окружить двойную спираль. Если это так, то нетрудно представить себе, что процесс выбора основания может протекать так, как это показано на рис. 15-5. На приведенном рисунке изображено гуаниновое основание матричной цепи молекулы ДНК, расположенное в месте наращивания комплементарной цепи (ДНК или РНК) с 3'-конца. Для образования правильной пары оснований соответствующий нуклеозидтрифосфат должен быть пристроен до того, как произойдет реакция замещения, в результате которой нуклеотид присоединится к растущей цепи. Предположим, что у фермента есть связывающие места для дезоксирибозного компонента матричного нуклеотида и для сахарного компонента включающегося нуклеозидтрифосфата, причем эти места расположены на строго определенном расстоянии друг от друга. Как показано на рис. 15-5, в каждом связывающем
участке может присутствовать также какая-либо группа Н—Y, образующая водородную связь с азотом или водородом (обозначены толстыми жирными стрелками). Следует отметить, что такие водородные связи в одном и том же положении относительно дезоксирибозных или рибозных колец могут образовывать все четыре основания. Далее мы можем представить себе, что гидрофобная область (на рисунке она соответствует заштрихованным участкам) способствует дополнительной стабилизации. Данная упорядоченная структура позволяет наглядно представить себе, как может быть выбран правильный нуклеозидтрифоефат независимо от того, каким из четырех оснований занято место связывания в левой части рисунка. (Контуры колец тимина и аденина изображены пунктирными линиями: пунктирная линия обозначает тимин, а штриховая — аденин.)
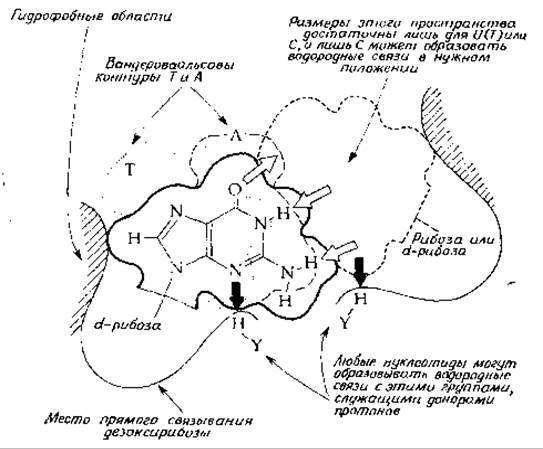
РИС. 15-5. Выбор правильного нуклеотида для следующей структурной единицы растущей цепи РНК или ДНК. Показан дезоксигуанозин матричной цепи, связанный с гипотетическим участком ДНК-полимеразы.
Существенная деталь схемы, показанной на рис. 15-5, состоит в том, что если пурин находится с левой стороны (как это показано на рисунке), то на правой стороне остается место лишь для пиримидинового кольца. Таким образом, вероятность наличия на правой стороне А и G исключена и остается выбирать только между С и U (или Т). Однако U не подойдет, потому что диполь, необходимый для образования водородной связи, расположен в этом основании в неправильном направлении. В растворе эти биполярные группы гидратированы. Маловероятно, чтобы эти группы отщепляли связанные с ними молекулы воды до образования водородных связей внутри пары оснований. Связыванию будет препятствовать, однако, не только то обстоятельство, что молекулы U (или Т) неспособны образовывать прочные водородные связи внутри свободного участка, показанного на рис. 15-5, но также наличие электростатического отталкивания одноименно заряженных концов диполей. В результате сродство РНК-полимераэы к неправильно спариваемым основаниям окажется сниженным. Снижение сродства (увеличение значения кажущейся Км) удалось наблюдать в эксперименте, по крайней мере для ДНК-полимеразы бактериофага Т4, для которой известны мутантные формы. Одна из них, «мутаторная» полимераза, при спаривании оснований делает намного больше ошибок именно потому, что она не способна со столь же высокой точностью различать основания в процессе спаривания, как это делает полимераза дикого штамма. Аналогично «антимутаторная» полимераза делает меньше ошибок, чем полимераза дикого штамма, причем комплементарные пары оснований она связывает еще более прочно относительно некомплементарных, чем это делает фермент дикого штамма [53b]. Более подробно этот вопрос рассматривается в работе Дрейка и Балца [53с].
Пары оснований обладают интересными таутомерными свойствами, в связи с чем напрашивается предположение, что многообразие таутомерных форм способствует правильному спариванию оснований и передаче какого-то сигнала на активный участок полимеразы, на котором происходит образование новой фосфодиэфирной связи. Чисто гипотетическая схема того, как это может происходить, показана на рис. 15-6. На этом рисунке группе Н—Y, изображенной на рис. 15-5, соответствует имидазольная группа, которая связана водородной связью с какой-то другой группой молекулы белка, способной к таутомерным переходам (гл. 6, разд. Д, 5, е). Как показывают изогнутые стрелки, пары электронов могут смещаться от атомов азота кольца. Такое смещение, возможно, обусловлено влиянием какой-нибудь отрицательно заряженной группы белка. Если водородные связи образованы правильно, то электроны могут направленно двигаться через пару оснований на группу Н—Y и далее через постулированную таутомерную цепь. Если пара оснований образована неправильно, то передача сигнала невозможна (за исключением тех случаев, когда неправильное спаривание происходит с минорным таутомером — гл. 2, разд. Г, 7). Следует иметь в виду, что возможен также и обратный электронный транспорт в направлении, противоположном указанному на рисунке, через ту же пару оснований. Сходные таутомерные переходы возможны для всех правильных пар оснований. Показанный на рисунке сигнал, вполне вероятно, также может возникать в результате присоединения какого-нибудь нуклеофила к пуриновому или пиримидиновому кольцу, например, как это показано на рис. 15-6, к атому С-6 цитозинового кольца. В случае рибосом подобные электронные сигналы могут передаваться через любую из пар оснований, участвующих в распознавании кодона антикодоном; они могут передаваться также и через пары оснований, которые образуются внутри шпилек рибосомной РНК. Хотя это не доказано, но вполне возможно, что пуриновые и пиримидиновые основания нуклеиновых кислот и коферментов служат местом активных изменений электронной конфигурации в процессе функционирования соответствующих соединений.
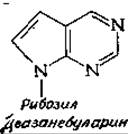
Следует помнить, что рассмотренные выше идеи носят спекулятивный характер; и могут oказаться совершенно неверными. Было пока зано, что РНК-полимераза может включать в РНК трифосфат деазанебуларина — нуклеозида, обладающего цитотоксическим действием,— который замещает (частично) либо аденозин, либо гуанозин [54].
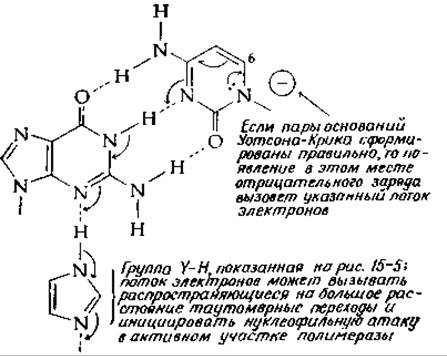
РИС. 15-6. Гипотетическая схема пути, по которому через пару оснований может быть послан электронный сигнал для инициации реакции в активном участке полимеразы нуклеиновых кислот.
Деазанебуларин может образовывать одну водородную связь с U, но не способен образовывать водородные связи с обычным таутомером С, из чего был сделан вывод, что при выборе основания главную роль играют стерические факторы, а образование водородных связей не имеет существенного значения. Хотелось бы надеяться, что читатель сам рассмотрит приведенные аргументы и сформулирует собственное мнение о механизмах выбора оснований, имеющего важнейшее значение для всех биологических процессов.
г. Терминация транскрипции
В ДНК закодированы не только сигналы инициации транскрипции, но также и сигналы терминации. Как происходит терминация роста цепи РНК, пока еще точно не установлено. Известно лишь, что некоторые сигналы терминации бактериальная РНК-полимераза распознает сама, тогда как для распознавания других сигналов необходимы дополнительные белки. Одним из таких белков, возможно, служит ро-фактор (р), индуцирующий терминацию цепей РНК in vitro [55]. р-Фактор Е. coli представляет собой белок с мол. весом 200 000, обладающий АТРазной активностью [55а].
д. Процессинг мРНК
Конечным результатом действия РНК-полимеразы у бактерий является образование ряда молекул мРНК различной длины, причем некоторые из них соответствуют полицистронным (полигенным, см. разд. Г, 3) оперонам, а другие — моноцистронным. Большинство образованных молекул мРНК нестабильно — средняя продолжительность их «жизни» составляет приблизительно, 2 мин. Однако некоторые из них, например молекулы мРНК, синтезируемые бактериями перед самой споруляцией, могут «жить» значительно дольше. Прежде чем попасть в рибосомы, молекулы мРНК подвергаются процессингу («созреванию»). Так, например, после заражения клеток Е. coli фагом Т7 специфическая рибонуклеаза расщепляет крупный (мол. вес 1,8-106) «ранний» РНК-транскрипт (разд. Г, 8) вирусной РНК на пять строго определенных фрагментов [56], каждый из которых содержит информацию, соответствующую одному вирусному гену. Процессинг информационной РНК в эукариотических клетках (разд. Б, 5) протекает значительно более сложно, чем у бактерий.